Chlorid antimonitý
| Chlorid antimonitý | |
|---|---|
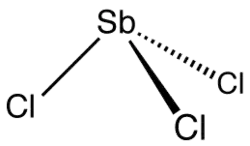 Strukturní vzorec | |
 Kuličkový model | |
 Krystalický trihydrát chloridu antimonitého | |
| Obecné | |
| Systematický název | chlorid antimonitý |
| Anglický název | Antimony trichloride |
| Německý název | Antimon(III)-chlorid |
| Sumární vzorec | SbCl3 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 10025-91-9 |
| PubChem | 24814 |
| SMILES | Cl[Sb](Cl)Cl |
| InChI | InChI=1S/3ClH.Sb/h3*1H;/q;;;+3/p-3 |
| Číslo RTECS | CC4900000 |
| Vlastnosti | |
| Molární hmotnost | 228,11 g/mol |
| Teplota tání | 73,4 °C |
| Teplota varu | 223,5 °C |
| Hustota | 3,14 g/cm3 |
| Index lomu | 1,46 |
| Rozpustnost ve vodě | 601,1 g/100 ml (0 °C) 985,1 g/100 ml (25 °C) 1357 g/100 ml (40 °C) |
| Rozpustnost v polárních rozpouštědlech | alkoholy, dichlormethan, ether, dioxan |
| Rozpustnost v nepolárních rozpouštědlech | tetrachlormethan |
| Bezpečnost | |
 GHS05  GHS09 Nebezpečí[1] | |
| NFPA 704 |  0
2
1
|
Některá data mohou pocházet z datové položky. | |
Chlorid antimonitý je anorganická sloučenina s vzorcem SbCl3. Jedná se o bezbarvou tuhou látku, která je silně hygroskopická.
Příprava
Chlorid antimonitý lze připravit reakcí antimonu, bromidu antimonitého, oxidu antimonitého nebo sulfidu antimonitého s chlorem. Také ho lze připravit reakcí koncentrované kyseliny chlorovodíkové s oxidem antimonitým.
Reakce
SbCl3 hydrolyzuje při styku se vzdušnou vlhkostí, proto je nutné jej přechovávat v inertní atmosféře. Reakcí s malým množstvím vody vzniká chlorid-oxid antimonitý a uvolňuje se chlorovodík.
- SbCl3 + H2O → SbOCl + 2 HCl
S větším množstvím vody vzniká Sb4O5Cl2, který zahříváním v atmosféře argonu přechází na Sb8O11Cl12.[2]
Využití
SbCl3 se využívá k důkazové reakci pro vitamín A a podobné karotenoidy, s kterými poskytuje modrý komplex. Ten lze stanovit kolorimetricky.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Antimony trichloride na anglické Wikipedii.
- ↑ a b Antimony trichloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ N. N. Greenwood – A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993, s. 698 ISBN 80-85427-38-9
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid antimonitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid antimonitý na Wikimedia Commons