Sulfid antimonitý
| Sulfid antimonitý | |
|---|---|
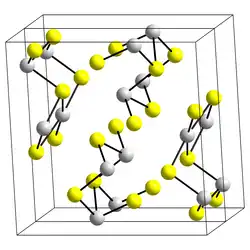 Krystalová struktura | |
| Obecné | |
| Systematický název | Sulfid antimonitý |
| Anglický název | Antimony(III) sulfide |
| Německý název | Antimon(III)-sulfid |
| Sumární vzorec | Sb2S3 |
| Vzhled | šedý až černý |
| Identifikace | |
| Registrační číslo CAS | 1345-04-6 |
| PubChem | 16689752 |
| SMILES | S1[Sb]2S[Sb]3S[Sb]1S[Sb](S2)S3 |
| Vlastnosti | |
| Molární hmotnost | 339,70 g/mol |
| Teplota tání | 548 °C |
| Hustota | 4,659 g/cm3 (20 °C) 4,12 g/cm3 (amorfní) |
| Index lomu | nDa= 3,194 nDb= 4,064 nDc= 4,303 |
| Tvrdost | 2 |
| Rozpustnost ve vodě | 0,000 175 g/100 g |
| Rozpustnost v polárních rozpouštědlech | methanol ethanol roztok K2S roztok NH4HS roztok HCl |
| Relativní permitivita εr | 11,15 (20 °C) |
| Struktura | |
| Krystalová struktura | kosočtverečná amorfní |
| Hrana krystalové mřížky | a= 1 123 pm b= 1 131 pm c= 383,9 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −173,6 kJ/mol −147,3 kJ/mol (amorfní) |
| Entalpie tání ΔHt | 138 J/g |
| Standardní molární entropie S° | 182 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −173,6 kJ/mol |
| Izobarické měrné teplo cp | 0,352 9 JK−1g−1 |
| Bezpečnost | |
 Zdraví škodlivý (Xn)  Nebezpečný pro životní prostředí (N) | |
| R-věty | R20/22, R51/53 |
| S-věty | S61 |
Některá data mohou pocházet z datové položky. | |
Sulfid antimonitý (chemický vzorec Sb2S3) je pevná látka, velmi málo rozpustná ve vodě, ovšem dobře rozpustná v roztocích rozpustných sulfidů nebo hydrogensulfidů. Se silnými kyselinami reaguje za vzniku antimonitých solí a uvolnění sulfanu, který způsobuje silný zápach po zkažených vejcích. V hydroxidech se rozpouští za vzniku antimonitanů. Na vzduchu hoří za vzniku oxidu antimonitého Sb4O6 a oxidu siřičitého SO2. Je to redukční činidlo, které se oxiduje za vzniku sloučenin Sb+V.
Struktura
Krystalická forma, minerál antimonit,[1] je tvořena pásky. Ty se skládají ze dvou typů antimonitých iontů, jeden má trigonálně-pyramidální koordinaci a druhý čtvercově pyramidální. Struktura je podobná Bi2S3 a Sb2Se3. Červená forma, minerál metastibnit, je amorfní.[2]
Příprava
Čistý sulfid antimonitý lze připravit reakcí chloridu antimonitého SbCl3 s thioacetamidem CH3CSNH2 v ethanolu nebo kyselině octové.
Nebo ho lze připravit spalováním práškovitého antimonu se sírou:[3]
- 2 Sb + 3 S → Sb2S3
Laboratorně ho lze jednoduše připravit srážením antimonité soli roztokem rozpustného sulfidu nebo sulfanem:
- 2 Sb3+ + 3 S2− → Sb2S3↓
Využití
Jako minerál byl sulfid antimonitý znám od starověku a používal se jako černý make-up pro barvení obočí a očních víček. Dnes se využívá jako přísada v zápalkách, pyrotechnice, do rubínově červených skel, jako barvivo na umělé hmoty a jako zpomalovač hoření.
Sulfid antimonitý je polovodič s vysokou citlivostí na světlo a byl použit v televizních kamerách a jiných optoelektronických zařízeních.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Antimon(III)-sulfid na německé Wikipedii.
- ↑ Stibnite. www.mindat.org [online]. [cit. 2025-08-22]. Dostupné online. (anglicky)
- ↑ Metastibnite. www.mindat.org [online]. [cit. 2025-08-22]. Dostupné online. (anglicky)
- ↑ GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium, 1993. 793 s. s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 710-711.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Sulfid antimonitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfid antimonitý na Wikimedia Commons