Tetrafluormethan
| Tetrafluormethan | |
|---|---|
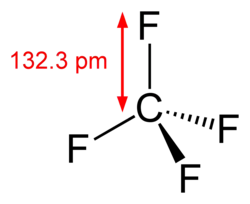 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | tetrafluormethan (organické názvosloví) (tetra)fluorid uhličitý (anorganické názvosloví) |
| Triviální název | tetrafluor |
| Ostatní názvy | perfluormethan, tetrafluorouhlík, Freon 14, Halon 14, Arcton 0, CFC 14, PFC 14, R 14, UN 1982 |
| Anglický název | Tetrafluoromethane |
| Německý název | Tetrafluormethan |
| Sumární vzorec | CF4 |
| Vzhled | bezbarvý plyn bez zápachu |
| Identifikace | |
| Registrační číslo CAS | 75-73-0 |
| EC-no (EINECS/ELINCS/NLP) | 200-896-5 |
| PubChem | 6393 |
| ChEBI | 38825 |
| UN kód | 94WG9QG0JN |
| SMILES | FC(F)(F)F |
| InChI | InChI=1S/CF4/c2-1(3,4)5 |
| Číslo RTECS | FG4920000 |
| Vlastnosti | |
| Molární hmotnost | 88,004 3 g/mol |
| Teplota tání | −183,6 °C (89,6 K) |
| Teplota varu | −127,8 °C (145,4 K) |
| Hustota | 0,003 72 g/cm3 (15 °C, plyn) |
| Index lomu | 1,113 |
| Rozpustnost ve vodě | 0,005 % objemu (20 °C), 0,003 8 % objemu (25 °C) |
| Rozpustnost v polárních rozpouštědlech | mísitelný s ethanolem a etherem |
| Rozpustnost v nepolárních rozpouštědlech | mísitelný s benzenem |
| Tlak páry | 3,65 MPa (15 °C), 106,5 kPa (−127 °C) |
| Struktura | |
| Tvar molekuly | tetraedrický |
| Bezpečnost | |
 GHS04 Varování[1] | |
| NFPA 704 |  0
1
0
|
| Teplota vzplanutí | prakticky nehořlavý |
| Teplota vznícení | 1 100 °C |
Některá data mohou pocházet z datové položky. | |
Tetrafluormethan neboli fluorid uhličitý (CF4) je organická sloučenina patřící mezi halogenderiváty uhlovodíků.
Vazby
Vazby mezi atomy uhlíku a fluoru jsou nejsilnější vazby v organické chemii (vazby mají energii 515 kJ/mol).[2]
Reakce
Kvůli silným C-F vazbám je tetrafluormethan, stejně jako ostatní fluorované uhlovodíky, velmi stabilní. Je inertní ke kyselinám a hydroxidům, avšak s alkalickými kovy reaguje explozivně. Jeho tepelným rozkladem vznikají toxické plyny (karbonylfluorid a oxid uhelnatý) a v přítomnosti H2O často také fluorovodík.
Příprava
Čistý tetrafluormethan byl poprvé připraven v roce 1926.
CF4 může být připraven v laboratoři reakcí karbidu křemíku s fluorem:
SiC + 2 F2 → CF4 + Si.
Často je také připravován fluorací oxidu uhličitého, oxidu uhelnatého nebo fosgenu fluoridem siřičitým. Průmyslově se vyrábí reakcí fluoru s dichlordifluormethanem nebo chlortrifluormethanem, také je vytvářen během elektrolýzy fluoridů kovů za použití uhlíkové elektrody.
Použití
Tetrafluormethan se používá v elektronické mikrovýrobě samotný nebo v kombinaci s kyslíkem jako plazmový leptač pro křemík, oxid křemičitý a nitrid křemičitý.[3]
Nebezpečnost pro životní prostředí
Tetrafluormethan je silný skleníkový plyn. Je velmi stabilní, poločas rozpadu v atmosféře je asi 50 000 let a je 6 500krát silnějším skleníkovým plynem než oxid uhličitý.
V Guinnessově knize rekordů je tetrafluormethan uveden jako nejvíce perzistentní skleníkový plyn.
Zdravotní rizika
V závislosti na koncentraci může vdechování CF4 způsobit bolesti hlavy, nauzeu, závratě a poškození krevního oběhu.
Podobné sloučeniny
Reference
V tomto článku byl použit překlad textu z článku Tetrafluoromethane na anglické Wikipedii.
- ↑ a b Carbon tetrafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ O'Hagan D. Understanding organofluorine chemistry. An introduction to the C–F bond. Chem Soc Rev. 2008, s. 308–19. doi:10.1039/b711844a. PMID 18197347.
- ↑ K. Williams, K. Gupta, M. Wasilik. Etch Rates for Micromachining Processing - Part II J. Microelectromech. Syst., vol. 12, pp. 761-777, December 2003.
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetrafluormethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrafluormethan na Wikimedia Commons