Oktafluorpropan
| Oktafluorpropan | |
|---|---|
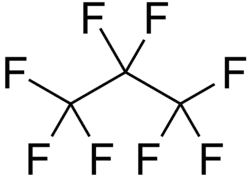 Strukturní vzorec | |
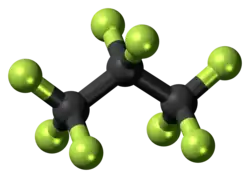 Model molekuly | |
| Obecné | |
| Systematický název | oktafluorpropan |
| Funkční vzorec | CF3CF2CF3 |
| Sumární vzorec | C3F8 |
| Vzhled | bezbarvý plyn[1] |
| Identifikace | |
| Registrační číslo CAS | 76-19-7 |
| EC-no (EINECS/ELINCS/NLP) | 200-941-9 |
| PubChem | 6432 |
| ChEBI | 31980 |
| SMILES | C(C(F)(F)F)(C(F)(F)F)(F)F |
| InChI | InChI=1S/C3F8/c4-1(5,2(6,7)8)3(9,10)11 |
| Číslo RTECS | TZ5255000 |
| Vlastnosti | |
| Molární hmotnost | 188,02 g/mol |
| Teplota tání | −147,6 °C (131,6 K)[1] |
| Teplota varu | −36,6 °C (236,6 K)[1] |
| Viskozita | 0,0125 mPa.s (0 °C)[2] |
| Kritická teplota Tk | 71,90 °C (345,05 K) |
| Kritický tlak pk | 2,68 MPa |
| Rozpustnost ve vodě | 0,57 mg/100 ml (15 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu a chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 0,88 MPa[1] |
| Součinitel tepelné vodivosti | 13,8 mW·m−1·K−1[2] |
| Bezpečnost | |
 GHS06  GHS07  GHS08  GHS09 | |
| H-věty | H301 H311 H315 H319 H331 H335 H350 H411[1] |
| P-věty | P201 P202 P261 P264 P270 P271 P273 P280 P281 P301+310 P302+352 P304+340 P305+351+338 P308+313 P311 P312 P321 P322 P330 P332+313 P337+313 P361 P362 P363 P391 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Oktafluorpropan je organická sloučenina se vzorcem C3F8, perfluorovaná molekula odvozená od propanu. Používá se při výrobě polovodičů a léčiv.
Jedná se také o velmi silný skleníkový plyn.
Výroba
Oktafluorpropan lze vyrobit elektrochemickou fluorací nebo Fowlerovým procesem za použití fluoridu kobaltitého.[3]
Použití
Při výrobě elektroniky slouží směs oktafluorpropanu a kyslíku jako materiál na plazmové leptání oxidu křemičitého ve výrobě polovodičů, kdy dochází k selektivímu vyleptávání oxidů od kovů.[4]
Oktafluorpropan se pod označením R-218 používá jako složka chladicích směsí.
Oktafluorpropan byl navržen pro terraformování Marsu; jelikož vytváří 24 000krát silnější skleníkový efekt než oxid uhličitý, tak by mohl výrazně zkrátit dobu a omezit množství zdrojů potřebných k terraformování.[5]
Reference
V tomto článku byl použit překlad textu z článku Octafluoropropane na anglické Wikipedii.
- ↑ a b c d e f g h i j https://pubchem.ncbi.nlm.nih.gov/compound/6432
- ↑ a b Encyclopédie des gaz [online]. [cit. 2008-01-22]. Dostupné v archivu pořízeném z originálu dne 2016-03-03.
- ↑ R. D. Fowler; W. B. Buford; J. M. Hamilton; R. G. Sweet; C. E. Weber; J. S. Kasper; I. Litant. Synthesis of Fluorocarbons. Industrial & Engineering Chemistry Research. 1947, s. 292–298. doi:10.1021/ie50447a612.
- ↑ J. W. Coburn. Plasma-assisted etching. Plasma Chemistry and Plasma Processing. 1982, s. 1–41. doi:10.1007/BF00566856.
- ↑ D. Rogers. Studies in the Future of Experimental Terraforming. [s.l.]: [s.n.] Dostupné online.[nedostupný zdroj]
Externí odkazy
 Obrázky, zvuky či videa k tématu oktafluorpropan na Wikimedia Commons
Obrázky, zvuky či videa k tématu oktafluorpropan na Wikimedia Commons