o-xylen
| o-xylen | |
|---|---|
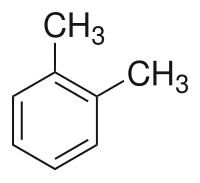 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,2-dimethylbenzen |
| Ostatní názvy | ortho-xylen |
| Sumární vzorec | C8H10 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 95-47-6 |
| EC-no (EINECS/ELINCS/NLP) | 202-422-2 |
| PubChem | 7929 |
| ChEBI | 28063 |
| SMILES | CC1=C(C)C=CC=C1 |
| InChI | InChI=1S/C8H10/c1-7-5-3-4-6-8(7)2/h3-6H,1-2H3 |
| Číslo RTECS | ZE2450000 |
| Vlastnosti | |
| Molární hmotnost | 106,16 g/mol |
| Teplota tání | −25 °C (248 K)[1] |
| Teplota varu | 144 °C (417 K)[1] |
| Hustota | 0,8801 g/cm3 (20 °C)[1] |
| Dynamický viskozitní koeficient | 0,760 mPa.s[1] |
| Index lomu | 1,5058 (20 °C)[1] |
| Rozpustnost ve vodě | nerozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu, diethyletheru, a tetrachlormethanu[1] |
| Tlak páry | 0,7 kPa (20 °C)[1] |
| Ionizační energie | 8,56 eV[1] |
| Povrchové napětí | 29,76 mN/m[1] |
| Termodynamické vlastnosti | |
| Standardní molární spalná entalpie ΔH°sp | 4,34 MJ/mol[1] |
| Entalpie varu ΔHv | 409 J/g (25 °C) 341 J/g (144,5 °C)[1] |
| Bezpečnost | |
 GHS02  GHS07 | |
| H-věty | H226 H312 H315 H319 H332[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264+265 P271 P280 P302+352 P303+361+353 P304+340 P305+351+338 P317 P321 P332+317 P337+317 P362+364 P370+378 P403+235 P501[1] |
| Teplota vzplanutí | 31 °C (304 K)[1] |
| Teplota vznícení | 463 °C (736 K)[1] |
Některá data mohou pocházet z datové položky. | |
o-Xylen (ortho-xylen) je aromatický uhlovodík, jeden ze tří izomerů dimethylbenzenu (xylenu). Předpona o- nebo ortho- označuje, že dvě methylové skupiny jsou u této látky na benzenovém jádře umístěny v polohách 1 a 2; dalšími izomery jsou m-xylen (1,3-dimethylbenzen) a p-xylen (1,4-dimethylbenzen). Stejně jako další xyleny je i p-xylen bezbarvý a vysoce hořlavý.[2]
Výroba a použití
Xyleny tvoří okolo 1 % hmotnosti ropy. Většina o-xylenu se získává krakováním, kterým se vytváří řada aromatických sloučenin, mezi nimi xyleny. m-Xylen se izomerizuje na o-xylen.
Nejvýznamnějším využitím o-xylenu je výroba ftalanhydridu, který lze přeměnit na řadu dalších látek, jako jsou léčiva.[2] Methylové skupiny se snadno oxidují a halogenují; například reakcí s bromem vzniká xylylendibromid:[3]
- C6H4(CH3)2 + 2 Br2 → C6H4(CH2Br)2 + 2 HBr
Reference
V tomto článku byl použit překlad textu z článku o-Xylene na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n o p q r s https://pubchem.ncbi.nlm.nih.gov/compound/7237
- ↑ a b ZIEGLER-SKYLAKAKIS, Kyriakoula; FABRI, Jörg; GRAESER, Ulrich. Xylenes. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a28_433.pub2. S. 1–20. (anglicky) DOI: 10.1002/14356007.a28_433.pub2.
- ↑ Emily F. M. Stephenson. o-Xylylene Dibromide. Organic Syntheses. 1954, s. 100. doi:10.15227/orgsyn.034.0100.
Externí odkazy
 Obrázky, zvuky či videa k tématu o-xylen na Wikimedia Commons
Obrázky, zvuky či videa k tématu o-xylen na Wikimedia Commons