Bromovodík
| Bromovodík | |
|---|---|
 Molekula bromovodíku v kuličkovém modelu | |
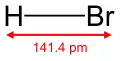 Vzorec | |
| Obecné | |
| Systematický název | broman |
| Latinský název | Hydrogenii bromidum Hydrogenium bromatum |
| Anglický název | Hydrogen bromide |
| Sumární vzorec | HBr |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 10035-10-6 |
| Vlastnosti | |
| Molární hmotnost | 80,91 g/mol |
| Teplota tání | −87 °C, 186 K |
| Teplota varu | −66 °C, 207 K |
| Hustota | 0,003 307 g/cm3 |
| Index lomu | 1,325 |
| Rozpustnost ve vodě | 193 g/100 ml (20 °C) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −36,45 až −36,15 kJ/mol |
| Standardní molární entropie S° | 198,696 až 198,704 JK−1mol−1 |
| Měrné teplo | 0,350 7 JK−1g−1 |
| Bezpečnost | |
 GHS05  GHS07 Nebezpečí[1] | |
| H-věty | H314 H335 |
| R-věty | R35, R37 |
| S-věty | (S2), S9, S26, S45 |
| NFPA 704 |  0
3
0
|
| Teplota vznícení | nehořlavý |
Některá data mohou pocházet z datové položky. | |
Bromovodík je bezkyslíkatá plynná sloučenina vodíku a bromu s ostrým, nepříjemným zápachem a vzorcem HBr, a řadí se mezi halogenovodíky. Při rozpouštění ve vodě vzniká kyselina bromovodíková se stejným vzorcem. Tato látka je poměrně užitečná v organické chemii, užívá se na výrobu některých léčiv. Vodný roztok, který obsahuje 47,6% bromovodíku tvoří azeotropní směs, která má bod varu 124,3 °C.
Výroba
Průmyslová
Průmyslově se tato látka vyrábí reakcí plynného bromu s vodíkem při teplotě mezi 200 a 400 °C. Při reakci se užívají katalyzátory, obvykle platina nebo azbest.[2]
Vzniklý produkt se následně ochlazuje na oddělení od nezreagovaného bromu, a vzniklý bromovodík je rozpouštěn ve vodě, a při tom je oddělen nezreagovaný vodík, který se ještě dá zužitkovat.
Laboratorní
Za laboratorních podmínek se dá vyrábět reakcí bromidu draselného se silnou kyselinou, obvykle s ředěnou kyselinou sírovou nebo kyselinou trihydrogenfosforečnou.[2]
Vzniká bromovodík, který se rychle rozpouští ve vodě, a při vypařování vody se z ní uvolňuje.
Při použití koncentrované kyseliny sírové dojde k oxidaci bromovodíku na brom.
Využití
Organická chemie
Při reakci s alkeny dochází k adici na nenasycenou vazbu:
- CH2=CH-CH3 + HBr → CH3-CBrH-CH3
S alkyny reaguje podobně:
- CH=C-CH + HBr → CH2=CBr-CH3
Je-li dostatek bromovodíku, reakce pokračuje takto:
- CH2=CBr-CH3 + HBr → CH3-CBr2-CH3
Tyto adice se řídí Markovnikovovým pravidlem, avšak bromovodík jako jediný halogenovodík dokáže překonat toto pravidlo, podmínkou je světlo a kyslík. Reakce pak probíhá takto:
- CH2=CH-CH3 + HBr → CH2Br-CH2-CH3
Tato látka reaguje s alkoholy za vzniku vody a bromderivátů:
Anorganická chemie
V anorganické chemii se používá na výrobu bromidů.
Bezpečnost
Bromovodík je vysoce korozivní a žíravý. Je silně dráždivý při vdechnutí. Je to silná bezkyslíkatá kyselina. Silně reaguje se všemi zásadami (včetně aminů a amidů). Při reakci s boridy, sulfidy, fosfidy nebo karbidy produkuje toxické a hořlavé plyny. Při styku s mnoha kovy (hliník, zinek, vápník, hořčík, železo, cín a alkalické kovy) se uvolňuje vodík.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Hydrogen bromide na anglické Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu bromovodík na Wikimedia Commons
Obrázky, zvuky či videa k tématu bromovodík na Wikimedia Commons - https://cameochemicals.noaa.gov/chemical/886
- http://www.cdc.gov/niosh/npg/npgd0331.html