Kyselina bromistá
| Kyselina bromistá | |
|---|---|
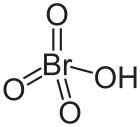 Strukturní vzorec | |
 Prostorový model | |
| Obecné | |
| Systematický název | Kyselina bromistá |
| Anglický název | Perbromic acid |
| Sumární vzorec | HBrO4 |
| Identifikace | |
| Registrační číslo CAS | 19445-25-1 |
| SMILES | O=Br(=O)(=O)OH |
| InChI | InChI=1S/BrHO4/c2-1(3,4)5/h(H,2,3,4,5) 1/BrHO4/c2-1(3,4)5/h(H,2,3,4,5) |
| Vlastnosti | |
| Molární hmotnost | 128,91 g/mol |
| Teplota tání | rozkládá se, v pevném stavu je nestabilní |
Některá data mohou pocházet z datové položky. | |
Kyselina bromistá je anorganická sloučenina se vzorcem HBrO4. Jedná se o kyslíkatou kyselinu bromu, brom má oxidační číslo VII. Je to nejméně stabilní kyselina z řady kyslíkatých kyselin halogenů v oxidačním čísle VII. Bezvodou kyselinu bromistou se dosud nepodařilo připravit.[1]
Nelze ji připravit záměnou chloru v kyselině chloristé, první příprava byla provedena pomocí β-přeměny selenanu:[2]
Její soli, bromistany, se připravují oxidací roztoků alkalických bromičnanů plynným fluorem:[1][2]
- KBrO3 + F2 + 2 KOH → KBrO4 + 2 KF + H2O
Kyselina bromistá je silná kyselina a také silné oxidační činidlo.[1] Rozkládá se za vzniku kyseliny bromičné a kyslíku. Se zásadami reaguje za vzniku bromistanů.
- 2 HBrO4 → 2 HBrO3 + O2
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Perbromic acid na anglické Wikipedii.
- ↑ a b c HOUSECROFT, Catherine; SHARPE, Alan. Anorganická chemie. 1. vyd. Praha: VŠCHT, 2014. 1119 s. ISBN 978-0273-74275-3. S. 604.
- ↑ a b GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemie prvků. Sv. 2.. 1. vyd. vyd. Praha: Informatorium, 1993. 13 s. S.794-1635 s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 1074–1076.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina bromistá na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina bromistá na Wikimedia Commons
Portály: Chemie