Kyselina bromičná
| Kyselina bromičná | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Kyselina bromičná |
| Anglický název | Bromic acid |
| Německý název | Bromsäure |
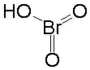
| Sumární vzorec | HBrO3 |
| Vzhled | Bezbarvá nebo nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7789-31-3 |
| Číslo RTECS | TP8580000 |
| Vlastnosti | |
| Molární hmotnost | 128,91 g/mol |
| Teplota rozkladu | 100 °C |
| Disociační konstanta pKa | 0,699 (18 °C) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −48,65 kJ/mol |
| Bezpečnost | |
 Žíravý (C) | |
Některá data mohou pocházet z datové položky. | |
Kyselina bromičná (HBrO3) je jednou ze čtyř kyslíkatých kyselin vytvářených bromem. Lze ji získat až v 50% vodném roztoku. Vzniká rozpouštěním bromu ve vodě za současné přítomnosti chloru:
- Br2 + 5 Cl2 + 6 H2O → 2 HBrO3 + 10 HCl
Praktické využití mají její soli, které se nazývají bromičnany. Anion BrO3 má náboj −1. Bromičnany se používají jako okysličovadla. Připravují se rozkladem bromnanů:
Bromičnany se také mohou připravit tavením chlorečnanu draselného s bromidem draselným:
- KClO3 + KBr → KBrO3 + KCl
Jejich reakcí s roztoky bromidů vzniká volný brom:
- KBrO3 + 5 KBr + 6 HCl → 3 Br2 + 6 KCl + 3 H2O
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina bromičná na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina bromičná na Wikimedia Commons
Portály: Chemie