Alotropy arsenu
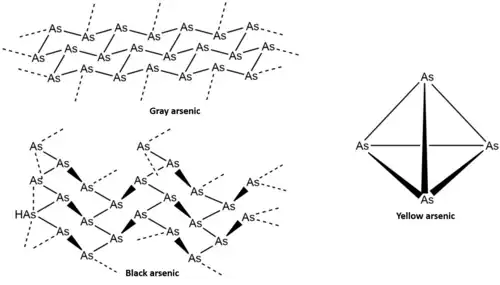
Pevný arsen vytváří tři alotropy lišící se zbarvením: šedý, černý, a žlutý; tyto formy se liší také strukturou a reaktivitou, přičemž nejreaktivnější je žlutý arsen.
Šedý arsen

Šedý, též kovový, arsen, je za pokojové teploty nejstálejší, a je tak i nejrozšířenější formou.[1] Jedná se o křehkou ocelově šedě zbarvenou pevnou látku, která je dobrým elektrickým vodičem.[2]
Klencová struktura tohoto alotropu je podobná jako u černého fosforu. Jeho α-forma vytváří kruhy v židličkové konformaci ze šesti atomů arsenu, propojené do vrstev kolmých ke krystalografické ose c. Vzdálenosti mezi sousedními As ve vrstvách jsou 251,7 pm a jednotlivé vrstvy mají mezi sebou 312,0 pm. Celková struktura vykazuje narušenou osmistěnnou geometrii, v důsledku čehož má tento alotrop vlastnosti podobné kovům. Při 616 °C nastává sublimace, v plynném skupenství se původní uspořádání ztrácí a vznikají drobné shluky As4, As2, a As, ve kterých převažuje As4.[1] Kondenzací těchto par na površích s teplotou pod 200 K se vytváří pevný žlutý arsen (As4), což je zapříčiněno nedostatkem energie pro tvorbu krystalů šedého arsenu; kondenzace za vyšších teplot vedou k amorfnímu černému arsenu - lze také izolovat krystalický černý arsen a amorfní formu je možné přeměnit na šedou. Šedý arsen je možné získat ze žlutého působením světla nebo návratem na pokojovou teplotu.[1]
Reakce
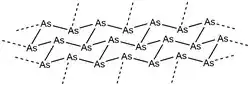
Šedý arsen je špatně rozpustný, a tak není známo mnoho jeho reakcí. Při vystavení vzduchu se oxiduje na As2O3. Jsou také popsány jeho reakce s přechodnými kovy,[3][4] při těchto reakcích se odštěpuje oxid uhelnatý z cyklopentadienylových komplexů molybdenu, wolframu, a chromu a vytvořené meziprodukty reagují se šedým arsenem za vzniku molekul obsahujících jeden, dva, nebo tři atomy arsenu.

Černý arsen

Černý arsen (Asn) se připravuje ve dvou krocích; prvním je sublimace šedého arsenu a druhým následná kondenzace na zahřívaném povrchu; vzniklá struktura je arsenovým analogem červeného fosforu. Krystalický černý arsen zaujímá, pokud není dostatečně čistý, strukturu podobnou černému fosforu, s kosočtverečnými krystaly složenými z kruhů As6. Černý arsen dosud nebyl připraven bez příměsí, jako jsou rtuť,[5] fosfor, a kyslík; čistý černý arsen byl ale nalezen v chilské provincii Copiapó. Zkoumáním minerálu arsenolampritu, nalezeného v místních jeskyních, byla zjištěna molekulová struktura se značnou anizotropií a polovodivost.[6]
Žlutý arsen
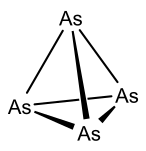
Rychlou kondenzací par arsenu na chladném povrchu se vytváří žlutý arsen (As4), skládající se ze čtyřatomových molekul uspořádaných do čtyřstěnné geometrie, podobné jako u bílého fosforu. Tato jediná známá rozpustná forma arsenu je metastabilní: za pokojové teploty, případně působením světla, se přeměňuje na šedý arsen, mající nižší energii; z tohoto důvodu je třeba jej udržovat v podobě vhodné pro reakce v temném prostředí a za teplot pod −80 °C.[1] Žlutý arsen je díky své rozpustnosti a molekulární struktuře alotropem nejvhodnějším pro zkoumání reakcí.
Tvorba sloučenin s prvky hlavní skupiny
První aktivace prvku hlavní skupiny žlutým arsenem byla popsána v roce 1992, šlo o reakci As4 s tetramesityldisilenem, za vzniku směsi několika sloučenin.[7] Složení produktů bylo odlišné od obdobné reakce P4, čímž se ukázalo, že reaktivita žlutého arsenu je jiná než u bílého fosforu. První sloučenina As4 s organickým substituentem byla získána roku reakcí radikálu CpPEt.[8] Produkt obsahoval As4 můstek, který se působením světla nebo tepla vratně přeměňoval na As4 a původní radikál. CpPEt2As4 se tak ukázal jako molekula vhodná pro „uchovávání“ žlutého arsenu, protože je za pokojové teploty ve tmě stálý, ale lze z něj uvolnit As4 světlem nebo zahřátím.

Dalších reakcí žlutého arsenu s prvky hlavní skupiny se účastní shluky arsenu obsahující více než čtyři atomy. Při reakci se silylenem [PhC(NtBu)2SiN(SiMe3)2] molekuly As4 was vytvářejí shluky o deseti atomech arsenu, kde se uprostřed nachází sedm atomů.[9]
Reakce se sloučeninami přechodných kovů
U prvků 4. a 5. skupiny
Žlutý arsen může reagovat s prvky 4. a 5. skupiny. S komplexy zirkonia obsahujícími karbonylové ligandy a deriváty cyklopentadienylu ve vroucím xylenu způsobuje odštěpování CO a navazování skupin As4 za tvorby η1:1-produktů.[11] Při téže reakci se také vyvořilo stopové množství zirkoniového dimeru obsahujícího můstkovou skupinu (μ,η2:2:1-As5), což činí připravené komplexy použitelnými jako nosiče As4.
Podrobněji byly zkoumány reakce arsenu s prvky 5. skupiny, kde jsou známy příslušné komplexy niobu i tantalu.[10][12]
S kovy 6. skupiny
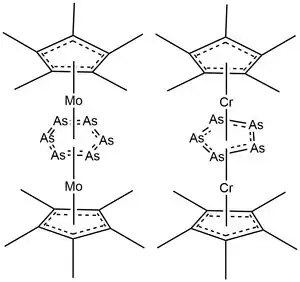
Reakce žlutého arsenu s kovy 6. skupiny probíhají nejčastěji jako termolytická odštěpování oxidu uhelnatého z karbonylových komplexů chromu a molybdenu. Jako příklady lze uvést tvorbu trojvrstvých komplexů [(CpRMo)2(μ,η6-As6)] a [{CpRCr}2(μ,η5-As5)] reakcemni příslušných dimerních sloučenin molybdenu a chromu.[14][13] Tyto komplexy obsahují tři rovinné kruhy, které jsou navzájem rovnoběžné. V obou případech reakce vyžadují tvrdé podmínky, jako jsou vroucí xylen; mírnějších reakčních podmínek lze dosáhnout použitím stericky mohutnějších ligandů. Sloučeniny typu Mo(N(tBu)Ar)3, které také štěpí trojné vazby N-N, reagují se žlutým arsenem za vzniku molekul obsahujících koncové arsenové skupiny připojené na kovová centra trojnými vazbami - jedná se o jedny z mála známých sloučenin s koncovými atomy arsenu.[15]
Nízké aktivační energie pro reakce s As4 mají i komplexy s násobnými vazbami mezi kovy. Sloučeniny obsahující paterné vazby chrom-chrom reagují se žlutým arsenem za vzniku komplexů s čtveřicí atomů arsenu vytvářející přibližně čtyřstěnnou strukturu, kde jsou na každý atom chromu navázány tři atomy arsenu.[16]
S kovy 8. a 9. skupiny

Kovy 8. a 9. skupiny mají popsán největší rozsah reakcí s arsenem, pžičemž se nejvíce zkoumají reakce As4 s komplexy železa a kobaltu. Komplexy železa typu (CpRFe(CO)2]2 reakcemi se žlutým arsenem, podobně jako jako u sendvičové komplexy chromu a molybdenu, vytvářejí trojvrstvé produkty. Podařilo se izolovat meziprodukt těchto reakcí, pentaarsaferrocen ([CpRFe(μ5-As5)]),[18] který má jeden cyklopentadienylový ligand nahrazen cyklickým As5, s vazbami As-As o délkách 231,2 pm. Tuto reaktivitu lze upravovat navázáním objemnějších ligandů. Záměna cyklopentadienylových skupin za objemnější vede k odlišným produktům. Působení světla vyvolává odpojování dalších CO ligandů a tvorbu můstkového komplexu, který se následně přesmykuje na komplex obsahující centrální skupinu As8; tento tetraaniontový ligand tvoří osmičlenný kruh propojující celkem čtyři atomy železa.[17]
Podobně reaguje žlutý arsen i se sloučeninami kobaltu. Dalším příkladem může být reakce As4 s tetrafluorboritanem kobaltnatým za přítomnosti 1,1,1-tris(difenylfosfinomethyl)ethanu, kdy vzniká komplex obsahující cyklické skupiny As3 spojující dva atomy kobaltu.[19] Reakce dimeru [Cp*Co(CO)]2 se žlutým arsenem vytváří řadu různých produktů obsahujících můstkové arsenové skupiny.[20]
Obdobné reakce jsou popsané i u komplexů rhodia.[21]
Reakce s kovy 10. a 11. skupiny
U kovů 10. a 11. skupiny jsou nejpodrobněji popsány reakce žlutého arsenu sw sloučeninami niklu a mědi. Tetrafluorboritany niklu podobně jako u kobaltu vytváří produkty se sendvičovou strukturou s centrem tvořeným cyklickou As3 skupinou. Podobně jako u železa reakce cyklopentadienyl-karbonylových komplexů s As4 vedou v závislosti na velikosti dalších přítomných liugandů k různým produktům, jejich vlastnosti a geometrická struktura se ale liší od produktů reakcí sloučenin železa.[19]
Reakcí komplexu [L2Cu(NCMe)] (L2 = [{N(C6H3iPr2-2,6)C(Me)}2CH]) se žlutým arsenem vzniká dimer s As4 můstkem [{L2Cu}2- (μ,η2:2-As4)].[22]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Allotropes of arsenic na anglické Wikipedii.
- ↑ a b c d e f g Michael Seidl; Gábor Balázs; Manfred Scheer. The Chemistry of Yellow Arsenic. Chemical Reviews. 2019-03-22, s. 8406–8434. Dostupné online. ISSN 0009-2665. doi:10.1021/acs.chemrev.8b00713. PMID 30900440.
- ↑ Allotrope : Arsenic [online]. [cit. 2020-11-01]. Dostupné online.
- ↑ a b M. L. Ziegler. Darstellung und Charakterisierung von Tetrahedranen des Typs Cp3M3As(CO)6 und Cp2M2As2(CO)4 (Cp = C5H5, M = Mo, W) sowie von Derivaten dieser Tetrahedrane. Chemische Berichte. 1988. ISSN 0009-2940. doi:10.1002/cber.v121:1.
- ↑ a b Lai Yoong Goh; Richard C. S. Wong; Wai Hing Yip; Thomas C. W. Mak. Synthesis and thermolysis of di- and triarsenic complexes of chromium. Crystal structure of [CpCr(CO)2]2As2. Organometallics. 1991, s. 875–879. ISSN 0276-7333. doi:10.1021/om00050a015.
- ↑ Nikolas Antonatos; Jan Luxa; Jiri Sturala; Zdenek Sofer. Black Arsenic: A New Synthetic Method by Catalytic Crystallization of Arsenic Glass. Nanoscale. 2020, s. 5397–5401. Dostupné online. ISSN 2040-3372. doi:10.1039/C9NR09627B. PMID 31894222.
- ↑ Yabin Chen, Chaoyu Chen, Huili Liu, Zhiquan Yuan, Lili Jiang, Joonki Suh, Joonsuk Park, Changhyun Ko, Hwan Sung Choe, José Avila. Black Arsenic: A Layered Semiconductor with Extreme In-Plane Anisotropy. Advanced Materials. 2018, s. 1800754. ISSN 1521-4095. doi:10.1002/adma.201800754. PMID 29893020.
- ↑ Robin P. Tan; Nadia M. Comerlato; Douglas R. Powell; Robert West. The Reaction of Tetramesityldisilene with As4: Synthesis and Structure of a Novel Arsenic–Silicon Tricyclic Ring System. Angewandte Chemie International Edition in English. 1992, s. 1217–1218. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.199212171.
- ↑ a b Sebastian Heinl; Gábor Balázs; Andreas Stauber; Manfred Scheer. CpPEt2As4-An Organic-Substituted As4Butterfly Compound. Angewandte Chemie International Edition. 2016-11-15, s. 15524-15527. Dostupné online. ISSN 1433-7851. doi:10.1002/anie.201608478. PMID 27862725.
- ↑ a b Andreas E. Seitz, Maria Eckhardt, Sakya S. Sen, Andreas Erlebach, Eugenia V. Peresypkina, Herbert W. Roesky, Marek Sierka, Manfred Scheer. Different Reactivity of As4 towards Disilenes and Silylenes. Angewandte Chemie International Edition. 2017, s. 6655–6659. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.201701740. PMID 28471032.
- ↑ a b Heather A. Spinney; Nicholas A. Piro; Christopher C. Cummins. Triple-Bond Reactivity of an AsP Complex Intermediate: Synthesis Stemming from Molecular Arsenic, As4. Journal of the American Chemical Society. 2009-11-11, s. 16233-16243. Dostupné online. ISSN 0002-7863. doi:10.1021/ja906550h. PMID 19842699.
- ↑ Monika Schmidt, Andreas E. Seitz, Maria Eckhardt, Gábor Balázs, Eugenia V. Peresypkina, Alexander V. Virovets, Felix Riedlberger, Michael Bodensteiner, Eva M. Zolnhofer, Karsten Meyer, Manfred Scheer. Transfer Reagent for Bonding Isomers of Iron Complexes. Journal of the American Chemical Society. 2017-09-27, s. 13981–13984. Dostupné online. ISSN 0002-7863. doi:10.1021/jacs.7b07354. PMID 28933848.
- ↑ Otto J. Scherer; Jürgen Vondung; Gotthelf Wolmershäuser. Tetraphosphacyclobutadiene as Complex Ligand. Angewandte Chemie International Edition in English. 1989, s. 1355–1357. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.198913551.
- ↑ a b Otto J. Scherer; Wolfgang Wiedemann; Gotthelf Wolmershäuser. Chrom-Komplexe mitcyclo-Asx-Liganden. Chemische Berichte. 1990, s. 3–6. Dostupné online. doi:10.1002/cber.19901230102.
- ↑ a b O. J. Scherer. A Triple- Decker Sandwich Complex with an Unstrained Cyclic Pentaarsane Middle Layer. Journal of Organometallic Chemistry. 1989, s. C11−C14. doi:10.1016/0022-328X(89)87363-2.
- ↑ John J. Curley; Nicholas A. Piro; Christopher C. Cummins. A Terminal Molybdenum Arsenide Complex Synthesized from Yellow Arsenic. Inorganic Chemistry. 2009-10-19, s. 9599−9601. Dostupné online. ISSN 0020-1669. doi:10.1021/ic9016068. PMID 19764796.
- ↑ Christoph Schwarzmaier, Awal Noor, Germund Glatz, Manfred Zabel, Alexey Y. Timoshkin, Brandi M. Cossairt, Christopher C. Cummins, Rhett Kempe, Manfred Scheer. Formation of cyclo-E42− Units (E4=P4, As4, AsP3) by a Complex with a Cr—Cr Quintuple Bond. Angewandte Chemie International Edition. 2011, s. 7283−7286. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.201102361. PMID 21698734.
- ↑ a b Christoph Schwarzmaier; Alexey Y. Timoshkin; Gábor Balázs; Manfred Scheer. Selective Formation and Unusual Reactivity of Tetraarsabicyclo[1.1.0]butane Complexes. Angewandte Chemie International Edition. 2014, s. 9077−9081. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.201404653. PMID 25123699.
- ↑ O. J. Scherer; Christof Blath; Gotthelf Wolmershäuser. Ferrocene mit einem Pentaarsacyclopentadienyl-Liganden. Journal of Organometallic Chemistry. 1990, s. C21–C24. Dostupné online. ISSN 0022-328X. doi:10.1016/0022-328X(90)80029-Y.
- ↑ a b Massimo Di Vaira; Stefano Midollini; Luigi Sacconi. cyclo-Triphosphorus and cyclo-triarsenic as ligands in "double sandwich" complexes of cobalt and nickel. Journal of the American Chemical Society. 1979, s. 1757–1763. Dostupné online. ISSN 0002-7863. doi:10.1021/ja00501a019.
- ↑ Otto J. Scherer; Karl Pfeiffer; Gotthelf Wolmershäuser. Cobaltkomplexe mit As4-Liganden. Chemische Berichte. 1992, s. 2367–2372. Dostupné online. ISSN 0009-2940. doi:10.1002/cber.19921251107.
- ↑ Otto J. Scherer; Bernd Höbel; Gotthelf Wolmershäuser. Zweifach kantengeöffnetes P10-Dihydrofulvalen als 16-Elektronendonorligand. Angewandte Chemie. 1992, s. 1042–1043. Dostupné online. ISSN 0044-8249. doi:10.1002/ange.19921040811.
- ↑ Fabian Spitzer; Marek Sierka; Mario Latronico; Piero Mastrorilli; Alexander V. Virovets; Manfred Scheer. Fixation and Release of Intact E4 Tetrahedra (E=P, As). Angewandte Chemie International Edition. 2015, s. 4392–4396. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.201411451. PMID 25677593.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu alotropy arsenu na Wikimedia Commons
Obrázky, zvuky či videa k tématu alotropy arsenu na Wikimedia Commons