Vazebná selektivita
Pojem vazebná selektivita označuje přednostní navazování ligandu na určitý receptor. Rovnovážná konstanta reakce, při které je jeden ligand nahrazen jiným, se nazývá koeficient selektivity. Vazebné selektivity mají velký význam v biochemii[1] a v chemických separačních metodách.
Koeficient selektivity
Míru selektivity při navazování látky A na dva různé substráty, B a C, lze vyčíslit. V nejjednodušším případě mají oba vznikající komplexy stechiometrii 1:1; poté lze interakce popsat pomocí rovnovážných konstant KAB a KAC takto:
kde [X] označuje koncentraci látky (A, B, C, …).
Koeficient selektivity je definován jako poměr dvou rovnovážných konstant;
jedná se o rovnovážnou konstantu reakce odpovídající nahrazení ligandu B ligandem C.
Obdobnou definici je možné použít i u komplexů s odlišnou stechiometrií, ApBq a ApCq. Čím větší je koeficient selektivity, tím snadněji ligand C nahrazuje ligand B, k nahrazení tak postačuje nižší koncentrace C. Koeficienty selektivity se určují experimentálně měřením obou rovnovážných konstant, KAB a KAC.
Využití
V biochemii
V biochemii se substrát označuje jako receptor. Jedná se molekulu bílkoviny v plazmatické membráně nebo cytoplazmě buňky, na kterou se mohou vázat signální molekuly určitého druhu. Ligandem může být peptid nebo jiná menší molekula, například neurotransmiter, hormon, léčivo, či toxin. Specificitu receptoru určuje jeho prostorové uspořádání a způsobem navazování ligandu nekovalentními interakcemi, jako jsou vodíkové vazby nebo Van der Waalsovy síly.[2]
Po izolování receptoru často následuje vývoj syntetické látky, která může daný receptor stimulovat (být jeho agonista) nebo jej tlumit (pak se jedná o antagonistu). Léčivo cimetidin, používané proti žaludečním vředům, bylo vyvinuto jako antagonista H2, působící skrz chemickou úpravu molekuly k maximální specificitě vůči izolované tkáni obsahující receptor. Další výzkum, využívající modely kvantitativní závislosti aktivity na struktuře, vedl k jiným látkám, například ranitidinu.
Při vyšších dávkách se léčivo může vázat i na jiné receptory než ty označované jako „selektivní“.
V chelatační terapii
-
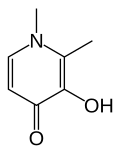 Deferipron
Deferipron -
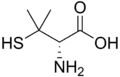 Penicilamin
Penicilamin
Chelatační terapie využívá chelatující ligandy k selektivnímu odstraňování kovů z těla. Při odstraňování dvojvazných kovových iontů, jako jsou například Pb2+ nebo Hg2+, je důležitá selektivita vůči Ca2+ a Mg2+, aby se neodstraňovaly kovy pro tělo důležité.[3]
Selektivitu určuje více faktorů. Při hromadění železa, například u jedinců s β-talasémií, kterým byla podána krevní transfuze, je cílovým iontem Fe3+ a chelatační činidlo by tak mělo s tímto iontem tvořit stálejší komplex než s dvojmocnými ionty. Původně se používal deferoxamin, látka přirozeně vytvářená bakterií Streptomyces pilosus; ta tvoří stálejší komplexy s donory kyslíku než s donory dusíku. Později byly vyvinuty syntetické náhrady, jako deferipron a deferasirox, využívající také strukturu deferoxaminu.[4][5] Chelataci zajišťují dva atomy kyslíku.
Wilsonovu nemoc způsobuje porucha metabolismu mědi, vedoucí k jejímu hromadění v různých částech těla. Cílovým iontem je zde Cu2+, který vytváří s ligandy využívajícími jako donorové atomy N, O, či F přibližně stejně stabilní komplexy jako s těmi, jež využívají P, S, nebo Cl.[6] K léčbě se používá penicilamin, obsahující jako donory atomy dusíku a síry; měďnaté ionty navazuje snadněji než vápenaté a hořečnaté.
Léčba otrav těžkými kovy, jako jsou olovo a rtuť, je složitější, protože používané ligandy nemají vysokou specificitu vůči vápníku; k jeho doplňování lze podávat vápenatou sůl kyseliny ethylendiamintetraoctové. Prozkoumány byly také faktory ovlivňující selektivitu olova vůči zinku, kadmiu, a vápníku.[7]
V chromatografii
Ve sloupcové chromatografii se směs látek rozpouští v mobilní fázi a prochází přes stacionární fázi. Určuje se zde faktor selektivity, a to jako poměr rozdělovacích koeficientů, popisující rovnováhu distribuce analytu mezi stacionární a mobilní fází. Tento faktor je roven koeficientu selektivity, s předpokladem, že aktivita stacionární fáze, sloužící jako substrát, je rovna 1.[8]
Rozlišení chromatografické kolony, RS, má takovýto vztah k faktoru selektivity:
kde α je faktor selektivity, N počet teoretických pater, a kA a kB retenční faktory uvažovaných analytů. Retenční faktory jsou přímo úměrné distribučním koeficientům. Nejsnáze se oddělují látky, jejichž faktor selektivity je blízko 1; tento poznatek se obzvláště uplatňuje v plynové chromatografii, kde mohou být kolony až 60 m dlouhé, a vytváří se tak velký počet teoretických pater. Při iontoměničové chromatografii je koeficient selektivity definován odlišně.[9]
Extrakce z rozpouštědla
Extrakce z rozpouštědla se používá při získávání jednotlivých lanthanoidů z přírodních směsí, jako jsou například monazity.
Ionty kovů ve vodném roztoku se převádějí do komplexů s tributylfosfátem, které se extrahují do organického rozpouštědla, například petroleje; extrakce se provádí v kaskádě tvořené extrakčními kolonami. Po dosažení rovnováhy se vodná složka z každé kolony převede do předchozí a organická do následující, která původně obsahovala pouze vodu. Ionty kovu vytvářejícího nejstálejší komplex procházejí dolů do organické fáze a ionty, jejichž komplex je nejméně stálý, se dostávají do vodné fáze.[10]
Koeficient selektivity je roven poměru konstant stability komplexů daných iontů s tributylfosfátem. U lanthanoidů nacházejících se na sousedních místech periodické tabulky bývají hodnoty tohoto poměru blízké 1, a kaskáda tak musí obsahovat velký počet kolon.
Chemická čidla
Potenciometrický koeficient selektivity určuje schopnost iontově selektivní elektrody odlišit jeden ion od ostatních. Tento koeficient, značený KB,C, se určuje pomoci odezvy elektrody ve smíšených roztocích primárního iontu B a rušivého iontu C, případně pomocí oddělených roztoků B a C;[11] například u draslíkových selektivních elektrod se využívá přírodní makrocyklické antibiotikum valinomycin - dutina v makrocyklu zde má právě takovou velikost, aby uzavřela draselný ion, ale je příliš velká na pevné navázání sodného iontu, který je při stanovování draslíku nejčastějším zdrojem rušení.
Chemická čidla se používají k zachycování specifických molekul pomocí tvorby komplexů. Senzory se vyvíjejí tak, aby přesně odpovídaly velikosti a tvaru cílové molekuly a dosáhlo se tak co nejlepší vazebné selektivity. K senzoru se připojuje indikátor, který při tvorbě komplexu změní své vlastnosti, například barvu (což se projeví na absorbanci), nebo luminiscenci.[12][13]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Binding selectivity na anglické Wikipedii.
- ↑ I. M. Klotz. Ligand-Receptor Energetics: A Guide for the Perplexed. [s.l.]: Wiley, 1997. Dostupné online. ISBN 978-0-471-17626-8.
- ↑ Textbook of receptor pharmacology. Příprava vydání J. C. Foreman , T. Johansen. [s.l.]: CRC Press, 2003. Dostupné online. ISBN 978-0-8493-1029-4.
- ↑ M. Walker; H. H. Shah. Everything you should know about chelation therapy. [s.l.]: [s.n.], 1997. Dostupné online. ISBN 978-0-87983-730-3.
- ↑ Robert C. Hider; Xiaole Kong. Interrelations between Essential Metal Ions and Human Diseases. Příprava vydání Astrid Sigel, Helmut Sigel, Roland K. O. Sigel. [s.l.]: [s.n.], 2013. ISBN 9789400774995. doi:10.1007/978-94-007-7500-8_8. PMID 24470094. Kapitola Chapter 8. Iron: Effect of Overload and Deficiency, s. 229–294.
- ↑ Marvin J. Miller. Syntheses and therapeutic potential of hydroxamic acid-based siderophores and analogs. Chemical Reviews. 1989, s. 1563–1579. doi:10.1021/cr00097a011.
- ↑ S. Ahrland; J. Chatt; N. R. Davies. The relative affinities of ligand atoms for acceptor molecules and ions. Quarterly Reviews. 1958, s. 265–276. doi:10.1039/QR9581200265.
- ↑ Etelka Farkas; Péter Buglyó. Lead: Its Effects on Environment and Health. [s.l.]: de Gruyter, 2017. ISBN 9783110434330. doi:10.1515/9783110434330-008. PMID 28731301. Kapitola Chapter 8. Lead(II) Complexes of Amino Acids, Peptides, and Other Related Ligands of Biological Interest, s. 201–240.
- ↑ D. A. Skoog; D. M. West; J. F. Holler; S. R. Crouch. Fundamentals of Analytical Chemistry. [s.l.]: Thomson Brooks/Cole, 2004. ISBN 978-0-03-035523-3.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. doi:10.1351/goldbook.s05566. (anglicky) DOI: 10.1351/goldbook.
- ↑ Rydberg, J.; Musikas, C; Choppin, G.R. Solvent Extraction Principles and Practice. [s.l.]: CRC Press, 2004. ISBN 978-0-8247-5063-3.
- ↑ R. P. Buck; E. Linder. Recommendations for nomenclature of ion-selective electrodes. Pure and Applied Chemistry. 1994, s. 2527–2536. doi:10.1351/Pac199466122527.
- ↑ Florinel-Gabriel Bănică, Chemical Sensors and Biosensors: Fundamentals and Applications, John Wiley and Sons, Chichester, 2012, Print ISBN 978-0-470-71066-1
- ↑ R. W. Cattrall. Chemical sensors. [s.l.]: Oxford University Press, 1997. Dostupné online. ISBN 978-0-19-850090-2.