Valinomycin
| Valinomycin | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | (3S,6S,9R,12R,15S,18S,21R,24R,27S,30S,33R,36R)-6,18,30-trimethyl-3,9,12,15,21,24,27,33,36-nona(propan-2-yl)-1,7,13,19,25,31-hexaoxa-4,10,16,22,28,34-hexazacyklohexatriakontan-2,5,8,11,14,17,20,23,26,29,32,35-dodekon |
| Ostatní názvy | cyklo[N-oxa-D-alanyl-D-valyl-N-oxa-L-valyl-D-valyl-N-oxa-D-alanyl-D-valyl-N-oxa-L-valyl-L-valyl-N-oxa-L-alanyl-L-valyl-N-oxa-L-valyl-L-valyl] |
| Sumární vzorec | C54H90N6O18 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 2001-95-8 |
| EC-no (EINECS/ELINCS/NLP) | 217-896-6 |
| PubChem | 3000706 |
| ChEBI | 28545 |
| SMILES | C[C@H]1C(=O)N[C@H](C(=O)O[C@@H](C(=O)N[C@@H](C(=O)O[C@H](C(=O)N[C@H](C(=O)O[C@@H](C(=O)N[C@@H](C(=O)O[C@H](C(=O)N[C@H](C(=O)O[C@@H](C(=O)N[C@@H](C(=O)O1)C(C)C)C(C)C)C(C)C)C)C(C)C)C(C)C)C(C)C)C)C(C)C)C(C)C)C(C)C |
| InChI | InChI=1S/C54H90N6O18/c1-22(2)34-49(67)73-31(19)43(61)55-38(26(9)10)53(71)77-41(29(15)16)47(65)59-36(24(5)6)51(69)75-33(21)45(63)57-39(27(11)12)54(72)78-42(30(17)18)48(66)60-35(23(3)4)50(68)74-32(20)44(62)56-37(25(7)8)52(70)76-40(28(13)14)46(64)58-34/h22-42H,1-21H3,(H,55,61)(H,56,62)(H,57,63)(H,58,64)(H,59,65)(H,60,66)/t31-,32-,33-,34+,35+,36+,37-,38-,39-,40+,41+,42+/m0/s1 |
| Vlastnosti | |
| Molární hmotnost | 1111,32 g/mol |
| Teplota tání | 190 °C (463 K)[1] |
| Rozpustnost ve vodě | nerozpustný[1] |
| Bezpečnost | |
 GHS05 | |
| H-věty | H300 H310[1] |
| P-věty | P262 P264 P270 P280 P301+316 P302+352 P316 P321 P330 P361+364 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Valinomycin je přírodní dodekadepsipeptid používaný jako antibiotikum a při transportu draselných iontů. Získává se z bakterií rodu Streptomyces, jako je například Streptomyces fulvissimus.
Tato látka patří mezi přírodní neutrální ionofory, protože nemá zbytkový náboj. Molekula se skládá z D- a L-enantiomerů valinu, kyseliny D-alfa-hydroxyizovalerové, a kyseliny L-mléčné. Jednotlivé složky jsou propojeny řetězcem střídajících se amidových a esterových vazeb. Valinomycin má v buněčných membránách vysokou selektivitu pro draselné ionty vůči sodným.[2]
Slouží jako specifický přenašeč draslíku a zprostředkovává průchod draselných iontů přes lipidové membrány ve směru záporného elektrochemického potenciálového gradientu.[3]
Konstanta stability komplexu draslík-valinomycin je téměř 100 000krát vyšší než u odpovídajícího komplexu sodíku.[4]
Struktura
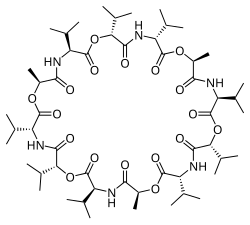
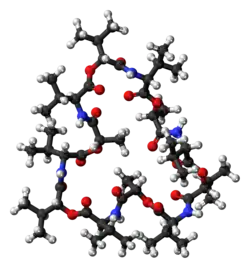
Valinomycin je dodekadepsipeptid, molekula tvořená dvanácti střídajícími se aminokyselinovými zbytky a esterovými skupinami za vzniku makrocyklu. Prostřednictvím dvanácti karbonylových skupin se navazují kovové ionty; tyto skupiny také zajišťují solvataci v polárních rozpouštědlech, v nepolárních je solvatace zprostředkovávána isopropyly a methyly.[5]
Kromě těchto skupin ovlivňuje vazebné vlastnosti valinomycinu také tvar jeho molekuly. Ionty mohou projít póry pouze tehdy, když odštěpí hydratující vodu. Ionty K+ vytváří s šesti karbonyly valinových zbytků oktaedrické uspořádání. Délka vazeb je 133 pm, zatímco u Na+ činí jen 95 pm, a Na+ tak nemohou vytvářet iontové vazby s aminokyselinami podobně silně jako s molekulami vody. Tento jev způsobuje 10 000násobnou selektivitu pro K+ oproti Na+. V polárních rozpouštědlech valinomycin vystavuje molekulám rozpouštědla především karbonylové skupiny, v nepolárních se na vnější straně molekuly nacházejí hlavně isopropylové skupiny; toto uspořádání se při navázání draselných iontů mění.
Použití
Valinomycin byl popsán jako účinný proti SARS-CoV v buňkách Vero E6.[6]
Valinomycin tlumí viry vaccinia.[7]
Valinomycin se používá jako součást draslíkových selektivních elektrod.[8][9]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Valinomycin na anglické Wikipedii.
- ↑ a b c d e f https://pubchem.ncbi.nlm.nih.gov/compound/3000706
- ↑ Lars Rose; A. T. A. Jenkins. The effect of the ionophore valinomycin on biomimetic solid supported lipid DPPTE/EPC membranes. Bioelectrochemistry. 2007, s. 387–393. doi:10.1016/j.bioelechem.2006.05.009. PMID 16875886.
- ↑ K. Cammann. Ion-selective bulk membranes as models. Topics in Current Chemistry. 1985, s. 219–258. ISBN 978-3-540-15136-4. doi:10.1007/3-540-15136-2_8.
- ↑ M. C. Rose; R. W. Henkens. Stability of sodium and potassium complexes of valinomycin. Biochimica et Biophysica Acta - General Subjects. 1974, s. 426–435. doi:10.1016/0304-4165(74)90204-9.
- ↑ M. Thompson; U. J. Krull. The electroanalytical response of the bilayer lipid membrane to valinomycin: membrane cholesterol content. Analytica Chimica Acta. 1982, s. 33–47. doi:10.1016/S0003-2670(01)95308-5. Bibcode 1982AcAC..141...33T.
- ↑ Dong Zhang; Zhi Ma; Hanchi Chen; Yuele Lu; Xiaolong Chen. Valinomycin as a potential antiviral agent against coronaviruses: A review. Biomedical Journal. 2020, s. 414–423. ISSN 2319-4170. doi:10.1016/j.bj.2020.08.006. PMID 33012699.
- ↑ Haydar Witwit, Beatrice Cubitt, Roaa Khafaji, Esteban M. Castro, Miguel Goicoechea, Maria M. Lorenzo, Rafael Blasco, Luis Martinez-Sobrido, Juan C. de la Torre. Repurposing Drugs for Synergistic Combination Therapies to Counteract Monkeypox Virus Tecovirimat Resistance. Viruses. 2025, s. 92. ISSN 1999-4915. doi:10.3390/v17010092.
- ↑ D. Safiulina; V. Veksler; A. Zharkovsky, A. Kaasik. Loss of mitochondrial membrane potential is associated with increase in mitochondrial volume: physiological role in neurones. Journal of Cellular Physiology. 2006, s. 347–353. doi:10.1002/jcp.20476. PMID 16110491.
- ↑ Potassium ionophore Bulletin [online]. [cit. 2009-05-19]. Dostupné online.