Uhličitan stříbrný
| Uhličitan stříbrný | |
|---|---|
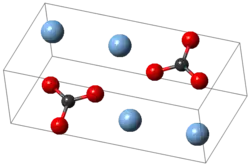 Krystalová struktura | |
 Vzorek mikrokrystalického uhličitanu stříbrného | |
| Obecné | |
| Systematický název | Uhličitan stříbrný |
| Anglický název | Silver carbonate |
| Německý název | Silbercarbonat |
| Sumární vzorec | Ag2CO3 |
| Vzhled | světle žluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 534-16-7 |
| PubChem | 92796 |
| SMILES | [Ag]OC(=O)O[Ag] |
| InChI | InChI=1S/CH2O3.2Ag/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 |
| Vlastnosti | |
| Molární hmotnost | 275,745 g/mol |
| Teplota tání | 218 °C (491 K) |
| Hustota | 6,077 g/cm3 |
| Rozpustnost ve vodě | prakticky nerozpustný |
| Rozpustnost v polárních rozpouštědlech | nerozpustný v ethanolu, kapalném amoniaku, acetonu a octanech |
| Součin rozpustnosti | 8,46×10−12 |
| Struktura | |
| Krystalová struktura | Jednoklonná (295 K) Klencová (453 K) Šesterečná (476 K) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −505,8 kJ/mol |
| Standardní molární entropie S° | 167,4 J⋅K−1⋅mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −436,8 kJ/mol |
| Měrné teplo | 112,3 J⋅K−1⋅mol−1 |
| Bezpečnost | |
 GHS05  GHS07  GHS09 Nebezpečí[1] | |
| H-věty | H315, H319, H335 |
| P-věty | P261, P305, P338, P351 |
| R-věty | R36, R37, R38 |
| S-věty | S26, S36 |
Některá data mohou pocházet z datové položky. | |
Uhličitan stříbrný je chemická sloučenina se vzorcem Ag2CO3. Uhličitan stříbrný je žlutý, ale typické vzorky jsou šedavé vzhledem k přítomnosti elementárního stříbra. Je špatně rozpustný ve vodě, jako většina uhličitanů přechodných kovů.
Příprava
Uhličitan stříbrný lze snadno připravit smícháním vodných roztoků uhličitanu sodného s nedostatkem dusičnanu stříbrného.[2] Čerstvě připravený uhličitan stříbrný je bezbarvý, ale jako pevná látka rychle mění barvu na žlutou.[3] Reaguje s amoniakem za vzniku fulminátu stříbrného. Při reakci s kyselinou fluorovodíkovou vzniká fluorid stříbrný.
Použití
Hlavní využití uhličitanu stříbrného je v mikroelektronice pro výrobu stříbrného prášku. Je redukován formaldehydem, přičemž se vytváří stříbro bez alkalických kovů.[3]
- Ag2CO3 + CH2O → 2 Ag + 2 CO2 + H2
Používá se jako činidlo v organické syntéze jako součást Koenigsovy–Knorrovy reakce.[2]
Reference
V tomto článku byl použit překlad textu z článku Silver carbonate na anglické Wikipedii.
- ↑ a b Silver carbonate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b MCCLOSKEY C. M.; COLEMAN, G. H. β-d-Glucose-2,3,4,6-Tetraacetate. Org. Synth.. 1955. Dostupné online.; Coll. Vol.. S. 434.
- ↑ a b Andreas Brumby et al.
Externí odkazy
 Obrázky, zvuky či videa k tématu uhličitan stříbrný na Wikimedia Commons
Obrázky, zvuky či videa k tématu uhličitan stříbrný na Wikimedia Commons