Uhličitan rubidný
| Uhličitan rubidný | |
|---|---|
 | |
| Obecné | |
| Systematický název | uhličitan rubidný |
| Anglický název | Rubidium carbonate |
| Německý název | Rubidiumcarbonat |
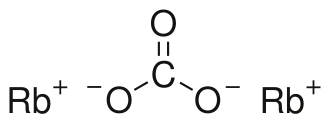
| Sumární vzorec | Rb2CO3 |
| Vzhled | bílý velmi hygroskopický prášek |
| Identifikace | |
| Registrační číslo CAS | 584-09-8 |
| PubChem | 11431 |
| Číslo RTECS | FG0650000 |
| Vlastnosti | |
| Molární hmotnost | 230,945 g/mol |
| Teplota tání | 837 °C[1] |
| Teplota rozkladu | 900 °C |
| Rozpustnost ve vodě | velmi dobře rozpustný |
| Bezpečnost | |
 GHS07 Varování[2] | |
Některá data mohou pocházet z datové položky. | |
Uhličitan rubidný je anorganická sůl (uhličitan) se vzorcem Rb2CO3. Jedná se o praktickou sloučeninu rubidia: je stabilní, není zvláště reaktivní, je velmi dobře rozpustný ve vodě a jedná se o obvyklou formu, ve které je rubidium prodáváno.
Příprava
Rb2CO3 se připravuje smícháním uhličitanu amonného s hydroxidem rubidným:
(NH4)2CO3 + 2 RbOH → Rb2CO3 + 2 NH3·H2O.[3]
Použití
Uhličitan rubidný se používá v některých druzích výroby skla za účelem zvýšení stability a životnosti, a snížení vodivosti. Také se používá jako součást katalyzátoru pro výrobu alkoholů s krátkým řetězcem.[4]
Odkazy
Podobné sloučeniny
Reference
V tomto článku byl použit překlad textu z článku Rubidium carbonate na anglické Wikipedii.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ a b Rubidium carbonate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ 1911encyclopedia.com. www.1911encyclopedia.org [online]. [cit. 2012-04-18]. Dostupné v archivu pořízeném dne 2007-11-02.
- ↑ Canada Patents. patents1.ic.gc.ca [online]. [cit. 2012-04-18]. Dostupné v archivu pořízeném dne 2011-07-06.
Externí odkazy
 Obrázky, zvuky či videa k tématu uhličitan rubidný na Wikimedia Commons
Obrázky, zvuky či videa k tématu uhličitan rubidný na Wikimedia Commons
Portály: Chemie