Thiofosgen
| Thiofosgen | |
|---|---|
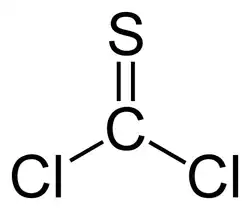 Strukturní vzorec | |
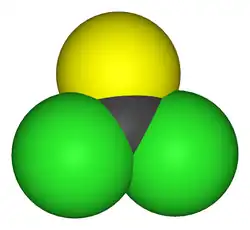 Model molekuly | |
| Obecné | |
| Systematický název | Karbonothoyldichlorid, dichlorid thiokarbonylu |
| Ostatní názvy | (di)chlorid kyseliny thiouhličité |
| Anglický název | Thiophosgene |
| Německý název | Thiophosgen |
| Sumární vzorec | CSCl2 |
| Vzhled | červená kapalina |
| Identifikace | |
| Registrační číslo CAS | 463-71-8 |
| PubChem | 10040 |
| SMILES | ClC(Cl)=S |
| InChI | InChI=1S/CCl2S/c2-1(3)4 |
| Vlastnosti | |
| Molární hmotnost | 114,98 g/mol |
| Teplota varu | 70–75 °C (343–348 K) |
| Hustota | 1,50 g/cm3 |
| Index lomu | 1,558 |
| Rozpustnost ve vodě | rozklad |
| Rozpustnost v polárních rozpouštědlech | rozpustný |
| Měrná magnetická susceptibilita | 4,40×105 μm3/g |
| Struktura | |
| Tvar molekuly | rovinná, sp2, C2v |
| Bezpečnost | |
 GHS06  GHS07 Nebezpečí[1] | |
| Teplota vzplanutí | 62 °C (335 K) |
Některá data mohou pocházet z datové položky. | |
Thiofosgen je anorganická sloučenina, obdoba fosgenu (kyslíkový atom je nahrazen sírou). Tato vysoce toxická červená kapalina se díky dvojici reaktivních C-Cl vazeb využívá v různých organických syntézách. [2]
Výroba
CSCl2 se vyrábí dvoufázovým procesem ze sirouhlíku. Nejprve je sirouhlík chlorován za vzniku trichlormethansulfenylchloridu (perchlormethylmerkaptanu), CCl3SCl:
- CS2 + 3 Cl2 → CCl3SCl + S2Cl2
Chlorace musí být regulována, jelikož přebytek chloru by přeměnil trichlormethansulfenylchlorid na chlorid uhličitý. Trichlormethansulfenylchlorid se spolu se sulfenylchloridem odstraní parní destilací, při tom dojde také k hydrolýze chloridu sirného. Redukcí trichlormethansulfenylchloridu vzniká thiofosgen:
- CCl3SCl + M → CSCl2 + MCl2
Jako redukční činidlo M se obvykle používá cín.
Použití
CSCl2 se většinou používá na přípravu sloučenin typu CSX2, kde X = OR, THR.[3] Mnohé tyto reakce probíhají přes meziprodukty jako například CSClX, za určitých podmínek lze takto přeměnit primární aminy na isothiokyanáty. CSCl2 také slouží jako dienofil po redukci 5-thiacyclohexenových derivátů. Také je využíván jako reaktant v Corey-Winterově syntéze na stereospecifickou přeměnu 1,2-diolů na alkeny.[4]
Reference
V tomto článku byl použit překlad textu z článku Thiophosgene na anglické Wikipedii.
- ↑ a b Thiophosgene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Manchiu D. S. Lay, Mitchell W. Sauerhoff And Donald R. Saunders "Carbon Disulfide" in Ullmann's Encyclopedia Of Industrial Chemistry, 2000, Wiley-VCH, Weinheim.
- ↑ Pascual, Roxana Martinez "Thiophosgene" Synlett 2015, vol. 26, pp. 1776-1777.
- ↑ SHARMA, S. Thiophosgene in Organic Synthesis. Synthesis. 1978, s. 803–820. doi:10.1055/s-1978-24896.
Externí odkazy
 Obrázky, zvuky či videa k tématu Thiofosgen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Thiofosgen na Wikimedia Commons