Styrenoxid
| Styrenoxid | |
|---|---|
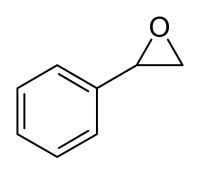 Strukturní vzorec | |
| Obecné | |
| Systematický název | 2-fenyloxiran |
| Ostatní názvy | fenyloxiran, epoxystyren |
| Anglický název | Styrene oxide |
| Sumární vzorec | C8H8O |
| Vzhled | bezbarvá až světle žlutá kapalina |
| Identifikace | |
| Registrační číslo CAS | 96-09-3 |
| PubChem | 7276 |
| ChEBI | 17907 |
| SMILES | c1ccccc1C2CO2 |
| InChI | InChI=1S/C8H8O/c1-2-4-7(5-3-1)8-6-9-8/h1-5,8H,6H2 |
| Vlastnosti | |
| Molární hmotnost | 120,15 g/mol |
| Teplota tání | −37 °C (236 K) |
| Teplota varu | 194 °C (467 K) |
| Hustota | 1,052 g/cm3 |
| Rozpustnost ve vodě | slabě rozpustný |
| Bezpečnost | |
 GHS07  GHS08 Nebezpečí[1] | |
| R-věty | R20 R22 R34 R36 R37 R38 |
Některá data mohou pocházet z datové položky. | |
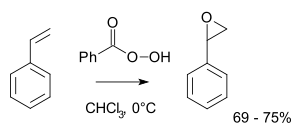
Styrenoxid je epoxid odvozený od styrenu. Lze jej připravit epoxidací styrenu:
Styrenoxid je slabě rozpustný ve vodě. I stopové množství kyseliny ve vodě způsobí hydrolýzu na racemický fenylethylenglykol přes arylkation. Pokud množství vody nestačí k proběhnutí této reakce, dojde ke kysele katalyzované izomeraci na fenylacetaldehyd.[2]
Styrenoxid je v těle metabolizován na kyselinu mandlovou, kyselinu fenylglyoxylovou, kyselinu benzoovou a kyselinu hippurovou.
Stereospecifické reakce
Jelikož má styrenoxid chirální centrum na benzylovém atomu uhlíku, existují dva enantiomery, (R)-styrenoxid a (S)-styrenoxid. Je.li použit opticky čistý reagent, vznikne pouze jeden z těchto izomerů.
Toxikologie
Styrenoxid je hlavním metabolitem styrenu u člověka a zvířat, vzniká oxidací cytochromen P450. Je považován za možný karcinogen.[3] Styrenoxid je hydrolyzován na styrenglykol pomocí enzymu epoxidhydrolázy.[4]
Styrenoxid je chirální a má tedy dva enantiomery. Bylo zjištěno, že (R)-styrenoxid více vzniká v tělech myší, zatímco (S)-styrenoxid převažuje u krys. U lidských dobrovolníků bylo po vystavení styrenu celkové vylučování (S)-izomeru styrenglykolu a kyseliny mandlové než u (R)-formy. V lidských jaterních mikrozomech cytochromem P450 řízená epoxidace styrenu vytvářela více (S)-izomeru než (R)-izomeru; (S)-enantiomer byl také hydrolyzován přednostně před (S)-enantiomerem. (R)-Styrenoxid je pro myši toxičtější než (S)-styrenoxid.
Reference
V tomto článku byl použit překlad textu z článku Styrene oxide na anglické Wikipedii.
- ↑ a b Styrene oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Verfahren zur Herstellung von Phenylacetaldehyden, BASF-Patent DE3546372A1 vom 2. Juli 1987. www.patent-de.com [online]. [cit. 2017-11-08]. Dostupné v archivu pořízeném z originálu dne 2017-12-05.
- ↑ EPA Styrene Oxide evaluation
- ↑ Kenneth C. Liebman. Metabolism and toxicity of styrene. Environmental Health Perspectives. 1975, s. 115–119. Dostupné online. doi:10.2307/3428333. JSTOR 3428333.[nedostupný zdroj]
Externí odkazy
 Obrázky, zvuky či videa k tématu Styrenoxid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Styrenoxid na Wikimedia Commons