Referenční elektroda
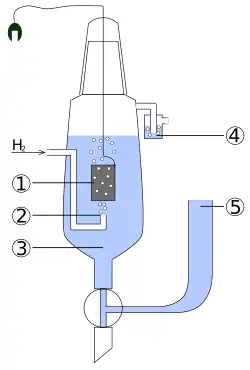
1) Platinová elektroda,
2) Plynný vodík,
3) Kyselý roztok s aktivitou H+ rovnou 1 mol/l,
4) Zátka bránicí rušivému působení kyslíku,
5) Zásobník ke kterému je připojen druhý poločlánek; spojení může být přímé, skrz úzkou trubici, která omezuje mísení, nebo přes solný můstek. Takto vzniká iontově vodivá dráha pro pracovní elektrodu.
Referenční elektroda je elektroda se stálým a dobře známým elektrodovým potenciálem. Celková reakce probíhající na této elektrodě se skládá ze dvou na sobě nezávislých poloreakcí. Referenční elektroda se standardizuje pomocí stálých (pufrovaných nebo nasycených) roztoků obou složek redoxní reakce.[1]
Referenční elektrody lze používat více způsoby. Nejjednodušším je její použití jako součásti elektrochemického článku, kdy lze změřit potenciál druhé části.
Referenční elektrody ve vodných roztocích
Běžné referenční elektrody mají tyto potenciály vůči standardní vodíkové elektrodě:
- Standardní vodíková elektroda (E = 0,000 V, aktivita H+ = 1 mol/l
- Vratná vodíková elektroda (E = 0,000 V - 0,0591 × pH) při 25 °C
- Nasycená kalomelová elektroda (E = +0,241 V)
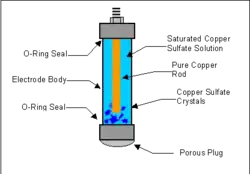
- Cu–CuSO4 elektroda (E = +0,314 V)
- AgCl elektroda (E = +0,197 V v nasyceném KCl)
- AgCl elektroda (E = +0,210 V v 3,0 molech KCl/kg)
- AgCl elektroda (E = +0,222 49 V v 3.0 molech KCl/l)[2]
- pH elektroda
- Palladium-vodíková elektroda
- Dynamická vodíková elektroda
- Hg-Hg2SO4 elektroda (E = +0,64 V v nasyceném K2SO4, E = +0,68 V v 0,5M H2SO4)

Elektrody nevyužívající vodné roztoky
Podobně jako jsou hodnoty pKa téže látky v různých rozpouštědlech odlišné, tak se liší rovněž E°. Standardní vodíková elektroda se jeví jako vhodná reference pro nevodné roztoky, tak ji řada rozpouštědel, jako je například acetonitril,[3] narušuje a způsobuje nekontrolovatelné změny potenciálu. Nasycená kalomelová i Ag/AgCl elektroda jsou založeny na nasycených vodných roztocích. Krátkodobě je lze použít jako reference pro nevodné roztoky, ale při delším používání se stávají nespolehlivými. Při používání elektrod obsahujících vodné roztoky vznikají proměnlivé a neměřitelné odchylky a změny iontového složení prostředí mezi referenčním oddílem a zbytkem článku.[4]
Potenciály naměřené v různých rozpouštědlech nelze přímo srovnávat;[5] například potenciál páru Fc0/+ je závislý na použitém rozpouštědle.[6][7]
| Rozpouštědlo | Vzorec nebo zkratka | E1/2 (V) (FeCp20/+ prosti standardní kalomelové elektrodě, 0,1M NBu4PF6 při 298 K) |
|---|---|---|
| Acetonitril | CH3CN | 0,40,[6] 0,382[7] |
| Dichlormethan | CH2Cl2 | 0,46,[6] 0,475[7] |
| Tetrahydrofuran | THF | 0,56,[6] 0,547[7] |
| Dimethylformamid | DMF | 0,45,[6] 0,470[7] |
| Aceton | (CH3)2C=O | 0,48[6] |
| Dimethylsulfoxid | DMSO | 0,435[7] |
| Dimethoxyethan | DME | 0,51,[6] 0.580[7] |
Výše uvedené potíže lze vyřešit použitím kvazireferenční elektrody, která se v nevodných roztocích používá s ferrocenem nebo jiným podobným standardem, například kobaltocenem nebo dekamethylferrocenem. Ferrocen se používá jako standardní reference pro nevodné roztoky od 60. let 20. století, a v roce 1984 doporučila Mezinárodní unie pro čistou a užitou chemii (IUPAC) ferrocen (0/1+) jako standardní redoxní pár.[8]
Příprava kvazireferenční elektrody je jednoduchá, a lze tak pro každou skupinu experimentů vytvořit novou. Protože se tyto elektrody připravují vždy před použitím, tak nepodléhají odchylkám v důsledku nesprávného skladování nebo zacházení. Jsou také cenově dostupnější než jiné referenční elektrody.
Kvazireferenční elektroda se sestaví takto:
- Stříbrný drát se ponoří do koncentrované HCl a následně se vysuší. Tímto se vytvoří na povrchu elektrody nerozpustná vrstva AgCl a vznikne Ag/AgCl drát (v případě posunu signálu se tento postup po několika měsících zopakuje).
- Skleněná frita (o průměru 4 mm) se připojí na skleněnou trubici podobného průměru.
- Trubice se omyje, ponoří do roztoku elektrolytu, a vloží se drát z Ag/AgCl.
- Ferrocenový (0/1+) by měl mít v acetonitrilovém roztoku potenciál oproti této elektrodě kolem 400 mV; za určitých podmínek se tento potenciál může posunout až na 200 mV, takže je třeba přidat interní standard, jako je například ferrocen.
Pseudoreferenční elektrody
Pseudoreferenční elektrody nemají stálý potenciál, ten se ale podle podmínek mění předvídatelně. Při znalosti podmínek lze potenciál vypočítat a elektrodu použít jako referenční. Většina elektrod funguje v omezeném rozpětí podmínek, jako jsou pH nebo teplota, a mimo toto rozmezí se stávají nepředvídatelnými. Výhodou pseudoreferenčních elektrod je, že vzniklé odchylky jsou zahrnuty do systému a lze tak provádět přesné analýzy v širokém rozmezí podmínek.
Elektrody se zirkoniovými membránami stabilizovanými yttriem jsou známy pro řadu redoxních párů, například Ni/NiO. Jejich potenciály jsou závislé na pH. Jestliže je hodnota pH známa, tak je lze použít jako reference, vhodné i pro vyšší teploty.[9]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Reference electrode na anglické Wikipedii.
- ↑ Allen J. Bard; Larry R. Faulkner. Electrochemical Methods: Fundamentals and Applications. [s.l.]: [s.n.] ISBN 978-0-471-04372-0.
- ↑ Bates, R. G. and MacAskill, J. B. (1978). "Standard potential of the silver-silver chloride electrode". Pure & Applied Chemistry, Vol. 50, pp. 1701–1706, http://www.iupac.org/publications/pac/1978/pdf/5011x1701.pdf
- ↑ Evelina Palibroda. Note sur l'activation anodique de la surface du métal support de l'électrode à hydrogène. Electroanalytical Chemistry and Interfacial Electrochemistry. 1967, s. 92–95. doi:10.1016/0022-0728(67)85013-7.
- ↑ Vitaly V. Pavlishchuk; Anthony W. Addison. Conversion constants for redox potentials measured versus different reference electrodes in acetonitrile solutions at 25°C. Inorganica Chimica Acta. 2000, s. 97–102. doi:10.1016/S0020-1693(99)00407-7.
- ↑ William E. Geiger. Organometallic Electrochemistry: Origins, Development, and Future. Organometallics. S. 5738–5765. doi:10.1021/om700558k.
- ↑ a b c d e f g Connelly, N. G., Geiger, W. E., "Chemical Redox Agents for Organometallic Chemistry", Chemical Reviews 1996, 96, 877
- ↑ a b c d e f g Aranzaes, J. R., Daniel, M.-C., Astruc, D. "Metallocenes as references for the determination of redox potentials by cyclic voltammetry. Permethylated iron and cobalt sandwich complexes, inhibition by polyamine dendrimers, and the role of hydroxy-containing ferrocenes", Canadian Journal of Chemistry, 2006, 84(2), 288-299 doi:10.1139/v05-262
- ↑ G. Gritzner; J. Kuta. Recommendations on reporting electrode potentials in nonaqueous solvents. Pure and Applied Chemistry. 1984, s. 461–466. Dostupné online. doi:10.1351/pac198456040461.
- ↑ R. W. Bosch, D. Feron, J. P. Celis, "Electrochemistry in Light Water Reactors", CRC Press, 2007
Související články
- Pomocná elektroda
- Cyklická voltametrie
Literatura
- ZANELLO, P. Inorganic Electrochemistry: Theory, Practice, and Application. [s.l.]: Royal Society of Chemistry, 2003-10-01. ISBN 978-0-85404-661-4.
- BARD, Allen J.; LARRY R. FAULKNER. Electrochemical Methods: Fundamentals and Applications. [s.l.]: Wiley, 2000-12-18. ISBN 978-0-471-04372-0.
- O’NEIL, Glen D.; BUICULESCU, Raluca; KOUNAVES, Samuel P.; CHANIOTAKIS, Nikos A. Carbon-Nanofiber-Based Nanocomposite Membrane as a Highly Stable Solid-State Junction for Reference Electrodes. Analytical Chemistry. 2011, s. 5749–5753. ISSN 0003-2700. doi:10.1021/ac201072u. PMID 21662988.
Externí odkazy
- Reference Electrodes [online]. [cit. 2020-06-29]. Dostupné online. ISBN 978-0123768568