Pictetova–Spenglerova reakce
Pictetova–Spenglerova reakce je kondenzační reakce β-arylethylaminů s aldehydy nebo ketony následovaná uzavíráním kruhů. Objevili ji v roce 1911 Amé Pictet a Theodor Spengler.[1]
Reakce se obvykle provádí v protickém rozpouštědle za kyselé katalýzy;[2] vysokých výtěžků však lze dosáhnout také v aprotických prostředích, přičemž někdy ani není nutná kyselá katalýza.[3] Pictetova–Spenglerova reakce je zvláštním případem Mannichovy reakce, probíhající podobným způsobem. Řídící silou reakce je elektrofilita iminiového iontu vytvořeného kondenzací aldehydu s aminem; tvorba tohoto iontu většinou vyžaduje kyselé prostředí, protože samotné iminy zpravidla nebývají dostatečně silnými elektrofily pro uzavírání kruhů.
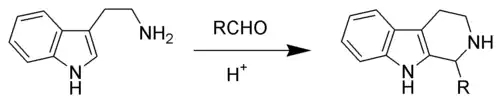
Pictetovy–Spenglerovy reakce mají průmyslová i biosyntetická využití. Používají se v organických syntézách, například u alkaloidů, kde jejich prostřednictvím vznikají beta-karboliny. Přírodní varianty probíhají za přítomnosti enzymů, například striktosidinsyntázy. Produkty Piktetových–Spenglerových reakcí byly nalezeny v řadě výrobků z přírodních surovin, například sójových omáčkách a kečupech; prekurzory zde často bývají aminokyseliny, například tryptofan, a sacharidy patřící mezi aldózy.
Nukleofilní aromatické kruhy, jako jsou indoly a pyrroly, reagují s vysokými výtěžnostmi i za mírných podmínek; slabší nukleofily, například fenylové sloučeniny, vykazují nižší výtěžky, případně vyžadují vyšší teploty a použití silných kyselin. Původní Pictetovou–Spenglerovou reakcí byla kondenzace fenylethylaminu s dimethoxymethanem, katalyzovaná kyselinou chlorovodíkovou, vytvářející tetrahydroisochinolin.
Obdobná reakce aryl-β-ethanolů se označuje jako oxa-Pictetova–Spenglerova reakce.[4]
Mechanismus
Mechanismus reakce začíná vznikem iminiového iontu (2), po kterém následuje elektrofilní adice v poloze 3, vytvářející spirocyklickou sloučeninu 3. Po přesmyku proběhne deprotonace, která vytvoří produkt (5).

Varianty
Pictetova–Spenglerova syntéza tetrahydroisochinolinů
Při nahrazení indolové skupiny 3,4-dimethoxyfenylovou proběhne reakce nazývaná Pictetova–Spenglerova syntéza tetrahydroisochinolinů. Probíhá za tvrdších podmínek než indolová reakce a vyžaduje reflux a použití silných kyselin, například chlorovodíkové, trifluoroctové, a nebo superkyselin.[5][6]
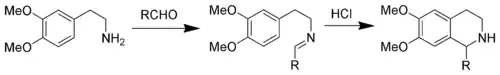
Picetova-Spenglerova reakce s N-acyliminiovými ionty
Při Pictetových–Spenglerových cyklizacích lze použít acylaci iminiových iontů na N-acyliminiové. N-acyliminiové ionty jsou silnými elektrofily a většina aromatických kruhů se poté cyklizuje s dobrými výtěžky i za mírných podmínek a bez nutnosti katalýzy silnou kyselinou.[7] Katalyzátory mohou být také chlorid zlatitý a trifluormethansulfonát stříbrný.[8]
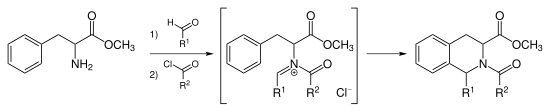
Reakcí tohoto druhu se vyrábí například tadalafil.[9]
Asymetrická Pictetova–Spenglerova reakce
Pokud se Pictetova–Spenglerova reakce provádí s jiným aldehydem než formaldehydem, tak se vytváří nové chirální centrum.[10][11]
Byla popsána chirální Brønstedova kyselina, která může katalyzovat asymetrické Pictetovy–Spenglerovy reakce.[12]
Diastereomerně řízené reakce tryptofanu
Reakce enantiomerně čistého tryptofanu nebo jeho alkylesterů s krátkými řetězci vytvářejí 1,2,3,4-tetrahydro-β-karboliny s novými chirálními centry na C-1, které mohou vůči C-3 karboxylu konfiguraci cis nebo trans. Tvorba cis formy je řízená kineticky, probíhá tedy za nižších teplot, zatímco při vyšších teplotách se reakce stává vratnou a většinou dochází k racemizaci. Převahy 1,3-trans produktů lze dosáhnout použitím Nb-benzylovaných tryptofanů, jež se dají připravit redukčními aminacemi; benzylovou skupinu lze oddělit hydrogenolýzou.
Signály C1 a C3 v 13C NMR jsou u cis produktů posunuté dolu oproti trans produktům.[3][13]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Pictet–Spengler reaction na anglické Wikipedii.
- ↑ A. Pictet; T. Spengler. Über die Bildung von Isochinolin-derivaten durch Einwirkung von Methylal auf Phenyl-äthylamin, Phenyl-alanin und Tyrosin. Berichte der Deutschen Chemischen Gesellschaft. 1911, s. 2030–2036. Dostupné online. doi:10.1002/cber.19110440309.
- ↑ W. M. Whaley; T. R. Govindachari. The Pictet-Spengler synthesis of tetrahydroisoquinolines and related compounds. Organic Reactions. 1951, s. 74.
- ↑ a b E. D. Cox; J. M. Cook. The Pictet-Spengler condensation: a new direction for an old reaction. Chemical Reviews. 1995, s. 1797–1842. doi:10.1021/cr00038a004.
- ↑ E. L. Larghi; T. S. Kaufman. The oxa-Pictet-Spengler Cyclization. Synthesis of Isochromanes and Related Pyran-Type Heterocycles. Synthesis. 2006, s. 187–210. doi:10.1055/s-2005-918502.
- ↑ Akihiro Yokoyama; Tomohiko Ohwada; Koichi Shudo. Prototype Pictet−Spengler Reactions Catalyzed by Superacids. Involvement of Dicationic Superelectrophiles. The Journal of Organic Chemistry. 1999, s. 611–617. doi:10.1021/jo982019e.
- ↑ R. Quevedo; E. Baquero; M. Rodriguez. Regioselectivity in isoquinoline alkaloid Synthesis. Tetrahedron Letters. 2010, s. 1774–1778. doi:10.1016/j.tetlet.2010.01.115.
- ↑ B. E. Maryanoff; H.-C. Zhang; J. H. Cohen; I. J. Turchi; C. A. Maryanoff. Cyclizations of N-acyliminium ions. Chemical Reviews. 2004, s. 1431–1628. doi:10.1021/cr0306182. PMID 15008627.
- ↑ S. W. Youn. Development of the Pictet-Spengler Reaction Catalyzed by AuCl3/AgOTf. The Journal of Organic Chemistry. 2006, s. 2521–2523. doi:10.1021/jo0524775. PMID 16526809.
- ↑ D. Bonnet; A. Ganesan. Solid-Phase Synthesis of Tetrahydro-β-carbolinehydantoins via the N-Acyliminium Pictet-Spengler Reaction and Cyclative Cleavage. Journal of Combinatorial Chemistry. 2002, s. 546–548. doi:10.1021/cc020026h. PMID 12425597.
- ↑ C. Gremmen; B. Willemse; M. J. Wanner; G.-J. Koomen. Enantiopure Tetrahydro-β-carbolines via Pictet-Spengler Reactions with N-Sulfinyl Tryptamines. Organic Letters. 2000, s. 1955–1958. doi:10.1021/ol006034t. PMID 10891200.
- ↑ Teodoro S. Kaufman "Synthesis of Optically-Active Isoquinoline and Indole Alkaloids Employing the Pictet-Spengler Condensation with Removable Chiral Auxiliaries Bound to Nitrogen". in "New Methods for the Asymmetric Synthesis of Nitrogen Heterocycles"; Ed.: J. L. Vicario. ISBN 81-7736-278-X Research SignPost, Trivandrum, India. 2005. Chapter 4, pp. 99–147
- ↑ J. Seayad; A. M. Seayad; B. List. Catalytic Asymmetric Pictet-Spengler Reaction. Journal of the American Chemical Society. 2006, s. 1086–1087. doi:10.1021/ja057444l. PMID 16433519.
- ↑ F. Ungemach, D. Soerens, R. Weber, M. Dipierro, O. Campos, P. Mokry, J. M. Cook, J. V. Silverton. General method for the assignment of stereochemistry of 1,3-disubstituted 1,2,3,4-tetrahydro-β-carbolines by carbon-13 spectroscopy. Journal of the American Chemical Society. 1980, s. 6976–6984. doi:10.1021/ja00543a012. Bibcode 1980JAChS.102.6976U.
Související články
- Bischlerova–Napieralského reakce
- Pomeranzova–Fritschova reakce
Externí odkazy
 Obrázky, zvuky či videa k tématu Pictetova–Spenglerova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pictetova–Spenglerova reakce na Wikimedia Commons