Peroxid sodný
| Peroxid sodný | |
|---|---|
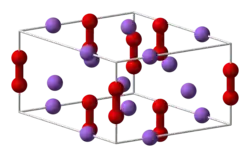 Model uspořádání atomů v peroxidu sodném | |
 Peroxid sodný | |
| Obecné | |
| Systematický název | peroxid sodný |
| Ostatní názvy | peroxid sodíku dioxid sodný |
| Latinský název | natrii peroxidum natrium peroxydatum |
| Anglický název | Sodium peroxide |
| Německý název | Natriumperoxid |
| Sumární vzorec | Na2O2 |
| Vzhled | žlutý až bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 1313-60-6 |
| EC-no (EINECS/ELINCS/NLP) | 215-209-4 |
| Indexové číslo | 011-003-00-1 |
| PubChem | 14803 |
| UN kód | 1504 |
| Číslo RTECS | WD3450000 |
| Vlastnosti | |
| Molární hmotnost | 77,98 g/mol |
| Teplota tání | 675 °C |
| Hustota | 2,805 g/cm3 |
| Struktura | |
| Krystalová struktura | hexagonální |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −513 kJ/mol |
| Standardní molární entropie S° | 95 JK−1mol−1 |
| Bezpečnost | |
 GHS03  GHS05 Nebezpečí[1] | |
| H-věty | H271 H314 |
| R-věty | R8 R35 |
| S-věty | (S1/2) S8 S27 S39 S45 |
Některá data mohou pocházet z datové položky. | |
Peroxid sodný (Na2O2) je sloučenina sodíku a kyslíku (v podstatě je to sodná sůl peroxidu vodíku). Je to světle žlutý prášek tavitelný bez rozkladu.
Jeho výroba spočívá ve spalování sodíku se vzduchem v hliníkových nádobách. Při styku s organickými a redukujícími látkami reaguje prudce až explozivně.
S oxidem uhelnatým reaguje za vzniku uhličitanu sodného. Při reakci s oxidem uhličitým vzniká mimo uhličitanu i kyslík.
- Na2O2 + CO → Na2CO3
- 2 Na2O2 + 2 CO2 → 2 Na2CO3 + O2
Této reakce se využívá ve speciálních dýchacích přístrojích pro hasiče a potápěče, či při obnovování vzduchu v uzavřených prostorách jako jsou ponorky nebo vesmírná plavidla.
S vodou reaguje Na2O2 prudce za vývoje velkého množství tepla. Z vodných roztoků lze získat snadno tavitelné destičkovité krystaly jako hydrát o složení Na2O2·8H2O.
Ve zředěných roztocích hydrolyzuje za vzniku peroxidu vodíku podle reakce
- Na2O2 + 2 H2O → 2 NaOH + H2O2
Peroxid sodný se využívá hlavně jako činidla v bělících lázních.
Reference
- ↑ a b Sodium peroxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Peroxid sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Peroxid sodný na Wikimedia Commons