Oxid osmičelý
| Oxid osmičelý | |
|---|---|
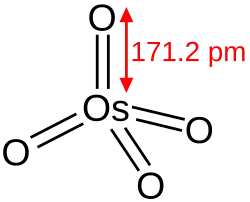 | |
 | |
 | |
| Obecné | |
| Systematický název | Oxid osmičelý |
| Anglický název | Osmium tetroxide |
| Německý název | Osmiumtetroxid |
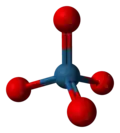
| Sumární vzorec | OsO4 |
| Vzhled | bílý prášek nebo krystalky (α) světležlutý prášek nebo krystalky (β) |
| Identifikace | |
| Registrační číslo CAS | 20816-12-0 |
| EC-no (EINECS/ELINCS/NLP) | 244-058-7 |
| Indexové číslo | 076-001-00-5 |
| PubChem | 30318 |
| UN kód | UN 2471 |
| Číslo RTECS | RN1140000 |
| Vlastnosti | |
| Molární hmotnost | 254,23 g/mol |
| Teplota tání | 39,5 °C (α) 40,6 °C (β) |
| Teplota varu | 131,2 °C |
| Hustota | 4,906 g/cm³ |
| Rozpustnost ve vodě | 5,26 g/100 ml (0 °C) 5,75 g/100 ml (10 °C) 6,47 g/100 ml (18 °C) 7,24 g/100 ml (25 °C) |
| Rozpustnost v polárních rozpouštědlech | methanol ethanol |
| Rozpustnost v nepolárních rozpouštědlech | diethylether tetrachlormethan 250 g/100 ml (20 °C) aromatické uhlovodíky |
| Tlak páry | 1,02 kPa (20 °C) |
| Ionizační energie | 12,97 eV |
| Struktura | |
| Krystalová struktura | jednoklonná (α) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −386 kJ/mol (α) −394 kJ/mol (β) |
| Entalpie tání ΔHt | 38,5 J/g (α) 56,3 J/g (β) |
| Entalpie varu ΔHv | 156 J/g |
| Standardní molární entropie S° | 168 JK−1mol−1 (α) 144 JK−1mol−1 (β) |
| Standardní slučovací Gibbsova energie ΔGf° | −304 kJ/mol (α) −305 kJ/mol (β) |
| Bezpečnost | |
 GHS05  GHS06 Nebezpečí[1] | |
| H-věty | H330 H310 H300 H314 |
| R-věty | R26/27/28, R34 |
| S-věty | S1/2, S7/9, S26, S45 |
| NFPA 704 |  0
4
1
OX
|
Některá data mohou pocházet z datové položky. | |
Oxid osmičelý (OsO4) je sloučeninou kyslíku s osmiem, které v něm má oxidační číslo VIII. Samotný oxid osmičelý je jedním z pěti doposud známých oxidů s prvkem v nejvyšším oxidačním stavu.
Oxid osmičelý tvoří nažloutlé krystaly, má nízkou teplotu tání, tavenina vře při 140 °C, je zapáchající. Vzniká oxidací osmia volným kyslíkem při teplotách okolo 400 °C nebo oxidací sloučenin osmia kyselinou dusičnou.[2]. Je kyselinotvorný, při jeho reakci s vodou vzniká kyselina osmičelá. Používá se jako oxidační činidlo při výrobě oxidu osmičitého. Jde o jedovatou sloučeninu, výpary poškozují rohovku a sliznice úst a nosu.[3]
Odkazy
Reference
- ↑ a b Osmium tetroxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1335.
- ↑ Osmium tetroxide. www.cdc.gov [online]. 2020-03-05 [cit. 2025-07-17]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxid osmičelý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid osmičelý na Wikimedia Commons
Portály: Chemie