Fluorid molybdeničný
| Fluorid molybdeničný | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid molybdeničný |
| Anglický název | Molybdenum(V) fluoride |
| Německý název | Molybdän(V)-fluorid |
| Sumární vzorec | MoF5 |
| Vzhled | žlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13819-84-6 |
| PubChem | 139613 |
| ChEBI | CHEBI:30711 |
| SMILES | F[Mo](F)(F)(F)F |
| InChI | InChI=1S/5FH.Mo/h5*1H;/q;;;;;+5/p-5
Key: NBJFDNVXVFBQDX-UHFFFAOYSA-I |
| Vlastnosti | |
| Molární hmotnost | 190,94 g/mol |
| Teplota tání | 45,7 °C (114,3 °F; 318,8 K) |
| Teplota varu | 50 °C (122 °F; 323 K) (sublimuje) |
| Hustota | 3,44 g/cm3 |
| Rozpustnost ve vodě | hydrolyzuje |
| Struktura | |
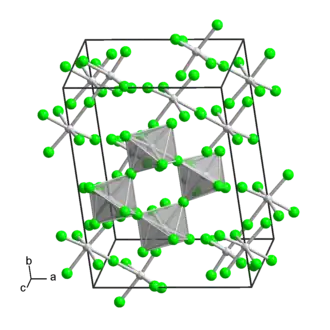
| Tvar molekuly | deformovaný oktaedr |
| Termodynamické vlastnosti | |
| Měrné teplo | 96,6 J·mol−1·K−1 |
Některá data mohou pocházet z datové položky. | |
Fluorid molybdeničný je anorganická sloučenina s chemickým vzorcem MoF5.
Příprava
Fluorid molybdeničný vzniká reakcí reakcí molybdenu s fluoridem molybdenovým:[1]
- Mo + 5 MoF6 → 6 MoF5
Fluorid molydeničný lze také připravit reakcí hexakarbonylu molybdenu s fluorem při teplotě −78 °C:[2]
- 2 Mo(CO)6 + 5 F2 → 2 MoF5 + 12 CO
Lze jej také připravit redukcí fluoridu molybdenového fluoridem fosforitým nebo hexakarbonylem wolframu.[1]
Lze jej také připravit oxidací molybdenu fluorem při teplotě 900 °C.[1]
Při teplotě okolo 165 °C fluorid molybdeničný disproporcionuje na fluorid molybdenový a molybdeničitý:[3]
- 2 MoF5 → MoF4 + MoF6
Vlastnosti
Fluorid molybdeničný je hygroskopická žlutá pevná látka, která existuje jako tetramer.[4] Na vzduchu dýmá.[2] Krystalová struktura se skládá z cyklických tetramerů [MoF5]4, které jsou složeny z deformovaných oktaedrů.
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Molybdenum(V) fluoride na anglické Wikipedii a Molybdän(V)-fluorid na německé Wikipedii.
- ↑ a b c OUELLETTE, T. J.; RATCLIFFE, C. T.; SHARP, D. W. A. Molybdenum(V) Fluoride (Molybdenum Pentafluoride). Příprava vydání F. A. Cotton. 1. vyd. Svazek 13. [s.l.]: Wiley Dostupné online. ISBN 978-0-470-13172-5, ISBN 978-0-470-13244-9. doi:10.1002/9780470132449.ch28. S. 146–150. (anglicky)
- ↑ a b BRAUER, Georg. Handbuch der präparativen anorganischen Chemie. [s.l.]: F. Enke 626 s. Dostupné online. ISBN 978-3-432-02328-1. S. 266. (německy)
- ↑ STENE, Riane E.; SCHEIBE, Benjamin; PIETZONKA, Clemens. MoF5 revisited. A comprehensive study of MoF5. Journal of Fluorine Chemistry. 2018-07, roč. 211, s. 171–179. Dostupné online [cit. 2024-02-06]. doi:10.1016/j.jfluchem.2018.05.002. (anglicky)
- ↑ EDWARDS, A. J. Crystal structure of tungsten pentafluoride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1969, s. 909. Dostupné online [cit. 2024-02-06]. ISSN 0022-4944. doi:10.1039/j19690000909. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid molybdeničný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid molybdeničný na Wikimedia Commons