Fluorid europnatý
| Fluorid europnatý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid europnatý |
| Anglický název | Europium(II) fluoride |
| Německý název | Europium(II)-fluorid |
| Sumární vzorec | EuF2 |
| Vzhled | tmavě žluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 14077-39-5 |
| EC-no (EINECS/ELINCS/NLP) | 678-686-1 |
| PubChem | 21225127 |
| SMILES | [F-].[F-].[Eu+2] |
| InChI | InChI=1S/Eu.2FH/h;2*1H/q+2;;/p-2
Key: YLDGIMHVWSTRML-UHFFFAOYSA-L |
| Vlastnosti | |
| Molární hmotnost | 189,96 g/mol |
| Teplota tání | 1403 °C (2557,4 °F; 1676,15 K) |
| Teplota varu | 2400 °C (4352 °F; 2673,15 K) |
| Hustota | 6,495 g/cm3 |
| Rozpustnost ve vodě | téměř nerozpustný |
| Struktura | |
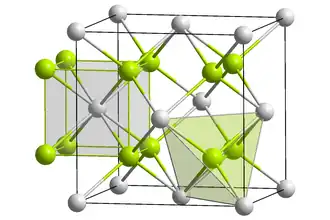
| Krystalová struktura | Struktura fluoritu |
| Hrana krystalové mřížky | a = 584,23 pm |
| Bezpečnost | |
 GHS06 | |
| H-věty | H301 |
| P-věty | P264, P270, P301+316, P321, P330, P405, P501 |
Některá data mohou pocházet z datové položky. | |
Fluorid europnatý je anorganická sloučenina s chemickým vzorcem EuF2. Fluorid europnatý byl poprvé připraven v roce 1937.[1]
Příprava
Fluorid europnatý lze připravit redukcí fluoridu europitého kovovým europiem nebo vodíkem:[2]
- 2 EuF3 + Eu → 3 EuF2
- 2 EuF3 + H2 → 2 EuF2 + 2 HF
Vlastnosti
Fluorid europnatý je světle žlutá pevná látka se strukturou fluoritu.[2] Při tlaku 114 kPa a při teplotě 400 °C přechází sloučenina na ortorombickou krystalickou strukturu (typu fluoridu olovnatého).[3]
Využití
Fluorid europnatý lze použít k dopování trojmocných fluoridů vzácných zemin, jako je fluorid lanthanitý, a vytvořit tak strukturu se zvýšenou vodivostí oproti čistému krystalu. Takové krystaly lze použít jako specifickou polopropustnou membránu v iontově selektivní elektrodě citlivé na fluoridy.[4][5]
Reference
V tomto článku byl použit překlad textu z článku Europium(II) fluoride na anglické Wikipedii.
- ↑ 赵, 永志; 马, 莹; 候, 少春. 氟化亚铕研究现状. 稀土. 2017, roč. 38, čís. 5, s. 134–140. Dostupné online [cit. 2023-09-30]. ISSN 1004-0277. doi:10.16533/j.cnki.15-1099/tf.201705017.
- ↑ a b BRAUER, Georg. Handbuch der präparativen anorganischen Chemie. [s.l.]: F. Enke 626 s. Dostupné online. ISBN 978-3-432-02328-1. (německy)
- ↑ Advances in Inorganic Chemistry and Radiochemistry. [s.l.]: Academic Press 383 s. Dostupné online. ISBN 978-0-08-057869-9. (anglicky)
- ↑ LIGHT, Truman S.; CAPPUCCINO, Carleton C. Determination of fluoride in toothpaste using an ion-selective electrode. Journal of Chemical Education. 1975-04, roč. 52, čís. 4, s. 247. Dostupné online [cit. 2023-09-30]. ISSN 0021-9584. doi:10.1021/ed052p247. (anglicky)
- ↑ FRANT, Martin S.; ROSS, James W. Electrode for Sensing Fluoride Ion Activity in Solution. Science. 1966-12-23, roč. 154, čís. 3756, s. 1553–1555. Dostupné online [cit. 2023-09-30]. ISSN 0036-8075. doi:10.1126/science.154.3756.1553. (anglicky)