Fluorid chlorný
| Fluorid chlorný | |
|---|---|
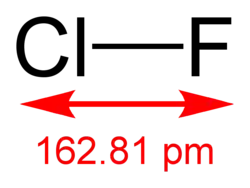 Struktura fluoridu chlorného | |
| Obecné | |
| Systematický název | Fluorid chlorný |
| Anglický název | Chlorine monofluoride |
| Německý název | Chlorfluorid |
| Sumární vzorec | ClF |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7790-89-8 |
| PubChem | 123266 |
| SMILES | ClF |
| InChI | InChI=1/ClF/c1-2 |
| Vlastnosti | |
| Molární hmotnost | 54,45 g/mol |
| Teplota tání | −155,6 °C |
| Teplota varu | −100,1 °C |
| Hustota | 1,62 g/cm3 (kapalina, −100 °C) |
| Struktura | |
| Dipólový moment | 0,881 D |
Některá data mohou pocházet z datové položky. | |
Fluorid chlorný je interhalogen s chemickým vzorcem ClF. Je to bezbarvý plyn, který je stabilní i za vysokých teplot. Při teplotách pod −100 °C kondenzuje na světle žlutou kapalinu. Mnoho jeho vlastností se pohybuje mezi hodnotami pro chlor a fluor.[1]
Reakce
Fluorid chlorný je velmi účinné fluorační činidlo, dokáže převést kovy i nekovy na jejich fluoridy za vývoje chloru. Například dokáže fluorovat wolfram a selen:[2]
- W + 6 ClF → WF6 + 3 Cl2
- Se + 4 ClF → SeF4 + 2 Cl2
Dokáže vystupovat i jako chlorační činidlo, většinou dochází zároveň i k oxidaci:[2]
- CO + ClF → COClF
- SO3 + ClF → ClOSO2F
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Chlorine monofluoride na anglické Wikipedii.
- ↑ RUFF, Otto; ASCHER, Ernst; FISCHER, Joseph. Das Chlorfluorid. Zeitschrift für anorganische und allgemeine Chemie. 1928-11-01, roč. 176, čís. 1, s. 258–270. Dostupné online [cit. 2019-06-02]. ISSN 0863-1786. doi:10.1002/zaac.19281760121. (německy)
- ↑ a b GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1015–1016.
Externí odkazy
 Obrázky, zvuky či videa k tématu fluorid chlorný na Wikimedia Commons
Obrázky, zvuky či videa k tématu fluorid chlorný na Wikimedia Commons
Portály: Chemie