Fürstovo–Plattnerovo pravidlo
Fürstovo–Plattnerovo pravidlo (také označované jako trans-diaxiální efekt) popisuje stereoselektivitu adicí nukleofilů na deriváty cyklohexenu.[1] Deriváty cyklohexenu, jako jsou iminy, epoxidy, a haloniové ionty, reagují s nukleofily stereoselektivně, přičemž jsou příslušné adice trans-diaxiální – tento pojem popisuje mechanismus adice, produkty ale bývají náchylné k přesmykům za vzniku konformerů s nižšími energiemi, majícími substituenty v ekvatoriálních polohách.
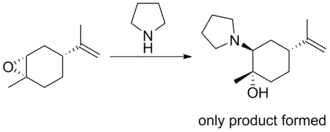
Mechanismus a stereochemie
Epoxidací substituovaného cyklohexenu vznikne produkt se substituentem v pseudoekvatoriální poloze. Nukleofilní otevírání kruhu tohoto epoxidu může proběhnout atakem v poloze C1 nebo C2. Vysokou regioselektivitu těchto reakcí přisuzuje Fürstovo–Plattnerovo pravidlo regiochemickému řízení výrazně upřednostňujícímu mechanismus zahrnující stabilnější přechodný stav s židličkovou konformací (čemuž odpovídá atak v poloze C1) oproti tomu, kde má přechodný stav lodičkovou konformaci (po ataku v poloze C2).[2][3] Atak v poloze C1 má mnohem nižší energetickou bariéru.
Fürstovo–Plattnerovo pravidlo se uplatňuje podobným způsobem také při nukleofilních adičních reakcích iminů a haloniových iontů.
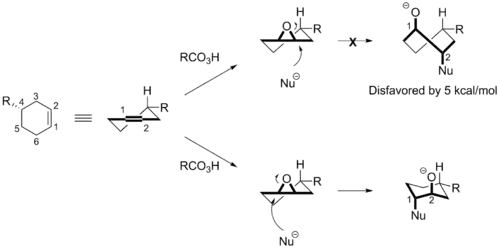
Příklady
Adice na epoxidy
Limonen byl epoxidován na směs diastereomerů v poměru 1:1. Reakcí s dusíkatým nukleofilem ve vodném roztoku za současného refluxování vznikal jeden otevřený produkt s enantiomerním přebytkem 75-85 %.[4]
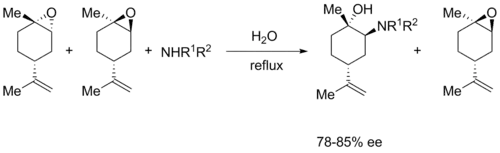
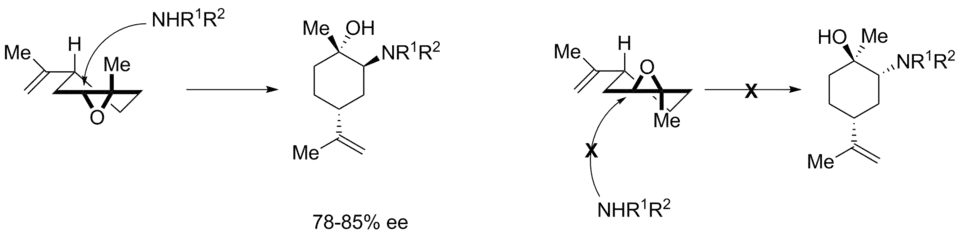
Mechanismus
Položidličková konfomace naznačuje, že atak probíhá stereoselektivně, když elektrofilní uhlík navazuje nukleofil způsobem vedoucím k produktu s židličkovou konformací.
Woodwardova syntéza reserpinu
Fürstovo–Plattnerovo pravidlo bylo důležitou součástí Woodwardovy syntézy reserpinu.[5] Příslušné stereocentrum je na následujícím obrázku zvýrazněno červeně:
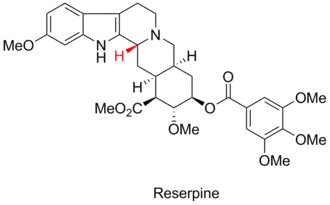
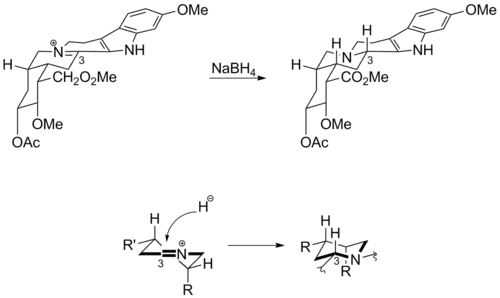
Woodwardův posrtup využil k přípravě tetrahydrokarbazolové části molekuly reserpinu Bischlerovu-Napieralského reakci. Vzniklý iminový meziprodukt poté reagoval s tetrahydridoboritanem sodným, čímž se v důsledku Fürstova–Plattnerova pravidla vytvářel nesprávný stereoizomer.

Prozkoumáním struktury meziproduktu bylo zjištěno, že se hydrid na 3-uhlík navazoval přednostně z horní strany iminu, kde se nevytvářel nevýhodný meziprodukt s ohnutou lodičkovou konformací. Tento výsledek způsobil, že k dokončení totální syntézy správného stereoizomeru reserpinu bylo potřeba provést několik dalších kroků.
Reference
V tomto článku byl použit překlad textu z článku Fürst-Plattner Rule na anglické Wikipedii.
- ↑ Fürst, A.; Plattner, P. A. Helvetica Chimica Acta 1949, 32, 275 (doi:10.1002/hlca.19490320139)
- ↑ Thomas Hansen; Pascal Vermeeren; Ryoji Yoshisada; Dmitri V. Filippov; Gijsbert A. van der Marel; Jeroen D. C. Codée; Trevor A. Hamlin. How Lewis Acids Catalyze Ring-Openings of Cyclohexene Oxide. The Journal of Organic Chemistry. 2021-02-19, s. 3565–3573. doi:10.1021/acs.joc.0c02955. PMID 33538169.
- ↑ Kirby, A. J. Stereoelectronic Effects, New York: Oxford Science Publications, 2002. p. 54
- ↑ Chrisman, W.; Camara, J. N; Marcellini, K.; Singaram, B.; Goralski, C. T.; Hasha, D. L.; Rudolf, P. R.; Nicholson, L.W.; Borodychuck, K. K. Tetrahedron Letters 2001, 42, 5805-5807 (doi:10.1016/S0040-4039(01)01135-2)
- ↑ R. B. Woodward, F. E. Bader, H. Bickel, A. J. Frey, R. W. Kierstead, Journal of the American Chemical Society 1956, 78 (9), pp 2023-2025