Ethyl-nitrát
| Ethyl-nitrát | |
|---|---|
 | |
| Obecné | |
| Systematický název | ethyl-nitrát ethylester kyseliny dusičné |
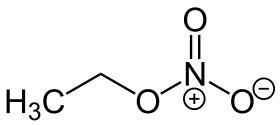
| Funkční vzorec | CH3CH2NO3 |
| Sumární vzorec | C2H5NO3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 625-58-1 |
| Vlastnosti | |
| Molární hmotnost | 91,07 g/mol |
| Teplota tání | −102 °C |
| Teplota varu | 87 °C |
| Bezpečnost | |
 GHS01 Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Ethyl-nitrát (CH3CH2NO3) se používá v organické syntéze a jako meziprodukt při přípravě některých léků, barviv a aromatických látek.
Ethyl-nitrát se nachází v atmosféře, kde může reagovat s jinými plyny a tím tvořit smog. Původně se myslelo, že je to znečišťující látka, která je tvořená hlavně při spalování fosilních paliv, ale nedávná analýza vzorků vody oceánů ukazují, že alkyl-nitráty je nasycená chladná voda v místech, kde stoupá z hlubin. Proto se usuzuje, že alkyl-nitráty jsou pravděpodobně tvořeny přírodními procesy.[2]
Příprava
Ethyl-nitrát se připravuje probubláváním plynného nitrylfluoridu přes ethanol při teplotě −10 °C.[3][4]
Reference
V tomto článku byl použit překlad textu z článku Ethyl nitrate na anglické Wikipedii.
- ↑ a b Ethyl nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ S. Perkins. Ocean yields gases that had seemed humanmade. sciencenews.org. Science News, August 12, 2002. Dostupné v archivu pořízeném dne 2007-10-17.
- ↑ G. Hetherington and R. L. Robinson. Nitryl fluoride as a nitrating agent. J. Chem. Soc.. 1954, s. 3512. doi:10.1039/JR9540003512.
- ↑ B. S. Fedorov and L. T. Eremenko. Nitration of alcohols by nitryl fluoride. Russian Chemical Bulletin. 1997, s. 1022–1023. doi:10.1007/BF02496138.
Externí odkazy
 Obrázky, zvuky či videa k tématu ethyl-nitrát na Wikimedia Commons
Obrázky, zvuky či videa k tématu ethyl-nitrát na Wikimedia Commons