Chlorid hexaamminnikelnatý
| Chlorid hexaamminnikelnatý | |
|---|---|
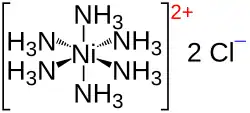 Strukturní vzorec | |
6Cl2.png) vzorek chloridu hexaamminnikelnatého | |
| Obecné | |
| Systematický název | chlorid hexaamminnikelnatý |
| Funkční vzorec | Ni(NH3)6Cl2 |
| Sumární vzorec | NiN6H18Cl2 |
| Vzhled | fialová pevná látka |
| Identifikace | |
| Registrační číslo CAS | 10534-88-0 |
| PubChem | 22221640 |
| SMILES | N.N.N.N.N.N.[Cl-].[Cl-].[Ni+2] |
| InChI | InChI=1S/2ClH.6H3N.Ni/h2*1H;6*1H3;/q;;;;;;;;+2/p-2 |
| Vlastnosti | |
| Molární hmotnost | 231,78 g/mol |
| Teplota tání | rozkládá se |
| Hustota | 1,51 g/cm3 |
Některá data mohou pocházet z datové položky. | |
Chlorid hexaamminnikelnatý je anorganická sloučenina se vzorcem [Ni(NH3)6]Cl2. Obsahuje hexaamminnikelnatý kation, složený z šesti amoniakových ligandů navázaných na nikelnatý kation.[1]
Vlastnosti a struktura
[Ni(NH3)6]2+ je, podobně jako další oktaedrické nikelnaté komplexy, paramagnetický; na každém Ni centru se nachází dva nepárové elektrony. Připravuje se reakcí vodného roztoku chloridu nikelnatého s amoniakem. Využití má jako zdroj nikelnatých iontů.[2]
Reference
V tomto článku byl použit překlad textu z článku Hexaamminenickel chloride na anglické Wikipedii.
- ↑ Ralf Eßmann, Guido Kreiner, Anke Niemann, Dirk Rechenbach, Axel Schmieding, Thomas Sichla, Uwe Zachwieja, Herbert Jacobs. Isotype Strukturen einiger Hexaamminmetall(II)‐halogenide von 3d‐Metallen: [V(NH3)6]I2, [Cr(NH3)6]I2, [Mn(NH3)6]Cl2, [Fe(NH3)6]Cl2, [Fe(NH3)6]Br2, [Co(NH3)6]Br2, und [Ni(NH3)6]Cl2. Zeitschrift für anorganische und allgemeine Chemie. 1996, s. 1161–1166. doi:10.1002/zaac.19966220709.
- ↑ G. S. Girolami, T. B. Rauchfuss, R. J. Angelici (1999) Synthesis and Technique in Inorganic Chemistry, University Science Books: Mill Valley, CA ISBN 0935702482
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid hexaamminnikelnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid hexaamminnikelnatý na Wikimedia Commons
Portály: Chemie