Bromid vápenatý
| Bromid vápenatý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Bromid vápenatý |
| Anglický název | Calcium bromide |
| Německý název | Calciumbromid |
| Sumární vzorec | CaBr2 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7789-41-5 22208-73-7 (dihydrát) 13477-28-6 (hexahydrát) |
| PubChem | 24608 |
| Číslo RTECS | EV9328000 |
| Vlastnosti | |
| Molární hmotnost | 199,89 g/mol 307,98 g/mol (hexahydrát) |
| Teplota tání | 730 °C 38,2 °C (hexahydrát) |
| Teplota varu | 810 °C |
| Teplota rozkladu | 149 °C (hexahydrát, dehydratace -6 H2O) |
| Hustota | 3,353 g/cm3 2,295 g/cm3 (hexahydrát) |
| Rozpustnost ve vodě | 125,2 g/100 g (0 °C) 132 g/100 g (10 °C) 143 g/100 g (20 °C) 153 g/100 g (25 °C) 213 g/100 g (40 °C) 278 g/100 g (60 °C) 295 g/100 g (80 °C) 312 g/100 g (105 °C) Hexahydrát 593,2 g/100 g (0 °C) 1 003,6 g/100 g (20 °C) |
| Rozpustnost v polárních rozpouštědlech | Methanol 50,4 g/100 g (0 °C) 56,2 g/100 g (20 °C) 97,8 g/100 g (60 °C) Aceton 2,72 g/100 g (20 °C) Glycerol Ethanol |
| Relativní permitivita εr | 6,15 |
| Měrná magnetická susceptibilita | −4,51·10−6 cm3g−1 −5,69×10−6 cm3g−1 (hexahydrát) |
| Struktura | |
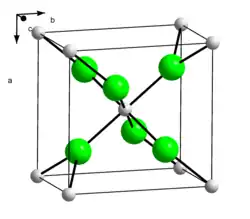
| Krystalová struktura | kosočtverečná šesterečná (hexahydrát) |
| Hrana krystalové mřížky | a= 655 pm b= 688 pm c= 434 pm Hexahydrát a= 797 pm b= 397 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −674,9 kJ/mol −2 500 kJ/mol (hexahydrát) |
| Entalpie rozpouštění ΔHrozp | −520,3 J/g −14,9 J/g (hexahydrát) |
| Standardní molární entropie S° | 130 JK−1mol−1 304,7 JK−1mol−1 (hexahydrát) |
| Standardní slučovací Gibbsova energie ΔGf° | −656,5 kJ/mol −2 118,9 kJ/mol (hexahydrát) |
| Bezpečnost | |
 GHS05  GHS07 Nebezpečí[1] | |
| R-věty | R36/37/38 |
| S-věty | S26, S36 |
| NFPA 704 |  0
1
0
|
Některá data mohou pocházet z datové položky. | |
Bromid vápenatý je vápenatá sůl kyseliny bromovodíkové, chemický vzorec má CaBr2. V tuhém stavu se jedná o bílé, silně hygroskopické krystalky. Je velmi dobře rozpustná ve vodě a o hodně lépe je rozpustný její hexahydrát. Dobře rozpustná je také v methanolu a poměrně málo i v acetonu.
Používá se v řezných kapalinách, léčivech, mrazicích směsích, potravinářských konzervantech, ve zpomalovačích hoření a v oblasti fotografie.[2]
CaBr2 lze připravit například reakcí oxidu vápenatého s kyselinou bromovodíkovou nebo reakcí kovového vápníku s elementárním bromem.
Při silném zahřívání CaBr2 na vzduchu vzniká oxid vápenatý a brom:
- 2 CaBr2 + O2 → 2 CaO + 2 Br2
V této reakci dochází k oxidaci bromidu na brom.
Reference
V tomto článku byl použit překlad textu z článku Calcium bromide na anglické Wikipedii.
- ↑ a b Calcium bromide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Chemical Land 21 [online]. [cit. 2008-12-25]. Dostupné online.
Externí odkazy
- MSDS - Calcium bromide hydrate Archivováno 4. 3. 2016 na Wayback Machine.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.