3-nitrochlorbenzen
| 3-nitrochlorbenzen | |
|---|---|
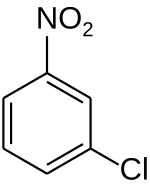 Strukturní vzorec | |
| Obecné | |
| Systematický název | 1-chlor-3-nitrobenzen |
| Anglický název | 3-nitrochlorobenzene |
| Sumární vzorec | C6H4ClNO2 |
| Vzhled | světle žluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 121-73-3 |
| EC-no (EINECS/ELINCS/NLP) | 204-496-1 |
| PubChem | 8489 |
| SMILES | C1=CC(=CC(=C1)Cl)[N+](=O)[O-] |
| InChI | InChI=1/C6H4ClNO2/c7-5-2-1-3-6(4-5)8(9)10/h1-4H |
| Vlastnosti | |
| Molární hmotnost | 157,55 g/mol |
| Teplota tání | 43 až 47 °C (316 až 320 K) |
| Teplota varu | 236 °C (509 K) |
| Hustota | 1,534 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a horkém ethanolu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru a benzenu |
| Bezpečnost | |
 GHS06  GHS07  GHS08  GHS09 Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
3-nitrochlorbenzen (systematický název 1-chlor-3-nitrobenzen) je organická sloučenina používaná jako surovina při výrobě řady dalších sloučenin. Je izomerní s 2-nitrochlorbenzenem a 4-nitrochlorbenzenem.
Výroba
Nitrochlorbenzen se obvykle vyrábí nitrací chlorbenzenu za přítomnosti kyseliny sírové:
- C6H5Cl + HNO3 → O2NC6H4Cl + H2O
Při této reakci vzniká směs izomerů, která většinou obsahuje 34–36 % 2-nitrochlorbenzenu, 63–65 % 4-nitrochlorbenzenu a kolem 1 % 3-nitrochlorbenzenu.
Jelikož je výše uvedený způsob pro výrobu 3-izomeru málo účinný, tak se nejčastěji používá chlorace nitrobenzenu. Reakce probíhá za přítomnosti katalyzátoru, přesublimovaného chloridu železitého, při teplotě 33–45 °C.[2]
Získávání čistého 3-nitrochlorbenzenu je obtížné, jelikož se při chloraci nitrobenzenu tvoří i další izomery, které mají podobné fyzikální vlastnosti. Usnadnit jej lze hydrolýzou aktivovaného chloru u 2- a 4- izomerů (vůči které je 3-izomer odolný).
Reakce
Na rozdíl od ostatních izomerů nitrochlorbenzenu není meta izomer aktivován nukleofilní substitucí na chlorovém centru. Na chlorovaném uhlíku 3-nitrochlorbenzenu lze provést alkylaci a nebo elektrofilní aromatickou substituci. 3-nitrochlorbenzen může být redukován na 3-chloranilin směsí Fe/HCl.
Použití
3-nitrochlorbenzen jako takový nemá velký význam, používá se však jako prekurzor dalších sloučenin.
Reference
V tomto článku byl použit překlad textu z článku 3-Nitrochlorobenzene na anglické Wikipedii.
- ↑ a b 1-Chloro-3-nitrobenzene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Nitro Compounds, Aromatic, Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. doi:10.1002/14356007.a17_411. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu 3-nitrochlorbenzen na Wikimedia Commons
Obrázky, zvuky či videa k tématu 3-nitrochlorbenzen na Wikimedia Commons